与化疗相比,第一三共Dato-DXd可改善既往接受过治疗NSCLC的无进展生存期 | 新闻稿
转自:研发客
· 第一三共和阿斯利康共同开发的Dato-DXd使总试验人群的疾病进展或死亡风险降低了25%,非鳞状非小细胞肺癌患者疾病进展或死亡风险降低了37%。
·Dato-DXd是首款相较于多西他赛对于那些远未被满足的治疗需求的疾病类型中显示出具有统计学意义改善的抗体偶联药物。

东京和新泽西州巴斯金里奇 ——关键性3期临床研究TROPION-Lung01的阳性结果表明,与现标准治疗多西他赛相比,datopotamabderuxtecan(Dato-DXd)在至少接受过一种既往疗法的局部晚期或转移性非小细胞肺癌(NSCLC)患者中的无进展生存期(PFS)出现具有统计学意义的改善。
该研究结果在2023年欧洲肿瘤内科学会(ESMO23)大会主席研讨会上进行了专题报告。Dato-DXd是一款由第一三共和阿斯利康共同开发,基于独有技术设计的TROP2靶向DXd抗体偶联药物(ADC)。
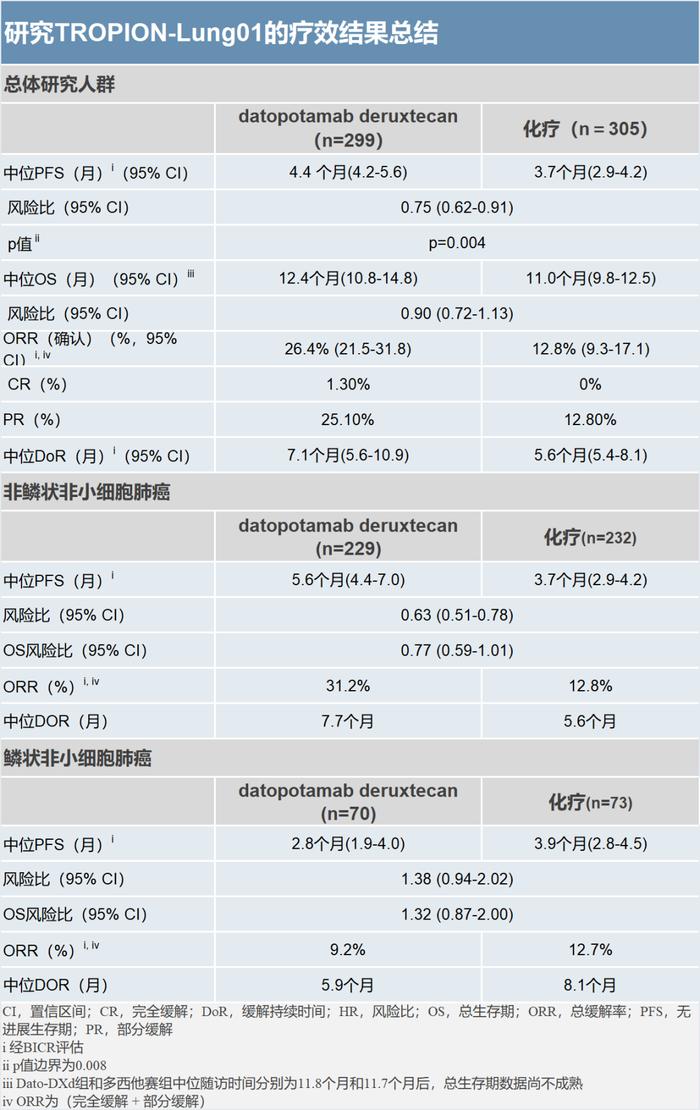
经盲态独立中心影像(BICR)评估,与多西他赛相比,Dato-DXd将疾病进展或死亡风险降低25%(风险比[HR]=0.75;95%置信区间[CI]:0.62-0.91;p=0.004)。接受Dato-DXd治疗的患者中位PFS为4.4个月,而接受多西他赛治疗的患者中位PFS为3.7个月。研究结果显示,接受Dato-DXd治疗的患者的确认的客观缓解率(ORR)为26.4%,而接受多西他赛治疗的患者的确认ORR为12.8%。Dato-DXd治疗组的中位缓解持续时间(DoR)为7.1个月(95%CI:5.6-10.9),而多西他赛治疗组的中位缓解持续时间(DoR)为5.6个月(95%CI:5.4-8.1)。
经BICR评估,在非鳞状NSCLC患者中,Dato-DXd显示出了有临床意义的获益,与多西他赛相比,Dato-DXd将疾病进展或死亡风险降低37%(HR=0.63;95%CI:0.51-0.78)。接受Dato-DXd治疗的患者的中位PFS为5.6个月,而接受多西他赛治疗的患者的中位PFS为3.7个月。Dato-DXd治疗组的确认的ORR为31.2%包括4例完全缓解(CRs),而多西他赛治疗组的ORR为12.8%且尚未观察到完全缓解的情况 。Dato-DXd治疗组和多西他赛治疗组的中位DoR分别为7.7个月和5.6个月。在鳞状细胞癌组织学特征患者中,Dato-DXd未显示出PFS获益。
在针对双主要终点总生存期(OS)的期中分析显示, 在总试验人群和非鳞癌患者中,Dato-DXd均显示出相对于化疗有数值上的获益趋势(总人群HR=0.90;95%CI:0.72-1.13,非鳞癌人群HR=0.77;95%CI:0.59-1.01) 。截至数据截止日期时,OS尚未达到未达到统计显著性。研究目前正在进行中,将在进一步分析中对OS进行评估。
加州大学洛杉矶分校医疗中心胸内肿瘤专家兼本研究的研究者AaronLisberg医学博士说:“对于晚期非小细胞肺癌患者而言,多西他赛作为目前二线的标准治疗不仅疗效有限且有较大的副作用。相较于化疗,尤其针对非鳞癌患者,Dato-DXd显示出无进展生存期的改善同时提高对抗体偶联药物的耐受性,这是一个非常重要的进展。”
在TROPION-Lung01研究中,与既往已报道数据相比,未发现新的安全性问题。相较于多西他赛组2.8个月的中位治疗时间,Dato-DXd组中位治疗持续时间为4.2个月。Dato-DXd治疗组和多西他赛治疗组因治疗相关3级或3级以上不良事件(TRAE)发生率分别为25%和41%。最常见3级或3级以上TRAE包括中性粒细胞减少症(1%vs.23%)、口腔黏膜炎(6%vs.1%)、贫血(4%vs.4%)、乏力(3%vs.2%)、恶心(2%vs.1%)和疲乏(1%vs.2%)。在Dato-DXd治疗组和多西他赛治疗组中,分别有3%和1%的患者经裁定发生了的3级或3级以上药物相关间质性肺疾病(ILD)事件。研究者初步判定疾病进展是导致该病例死亡的主要原因。在有7例5级ILD事件中,4例(1.7%)事件为非鳞状患者,3例(4.6%)事件为鳞状NSCLC患者。多西他赛治疗组发生了1例5级ILD事件(0.3%)。
第一三共全球研发负责人KenTakeshita医学博士说:“在ESMO期间公布的Dato-DXd的二项关键性研究结果,进一步证明第一三共的DXdADC技术有望改变不同靶点和癌症类型的治疗选择。在非鳞癌患者中的获益度令人尤为印象深刻,此外TROPION-Lung05研究的数据向人们展示了具有说服力的证据,证明Dato-DXd在治疗某些非小细胞肺癌亚型方面能够发挥重要作用,对于初治后复发转移非小细胞肺癌患者而言,他们的有效治疗选择较为有限。”
阿斯利康肿瘤研发部执行副总裁SusanGalbraith(MBBCHIR)博士说:“Dato-DXd在我们设想的未来中至关重要,我们预期其能够在多种癌症类型中改进并最终取代化疗等既定标准治疗。TROPION-Lung01的研究结果首次证明,抗体偶联药物较传统化疗可以相对有效地延缓晚期非小细胞肺癌患者的疾病进展。而此前并无优于化疗的其他方案,因此,此项研究取得的重要进展令人欣喜。”
各治疗组按肿瘤组织学特征划分的患者入组情况与实际数据一致,Dato-DXd治疗组和多西他赛治疗组中非鳞癌患者分别占有78%和77%。在Dato-DXd治疗组中,患者既往接受过含铂治疗(99%)、抗PD1/抗PDL1治疗(88%)或靶向治疗(15%)。在多西他赛治疗组中,患者既往接受过含铂化疗(100%)、抗PD1/抗PDL1治疗(88%)或靶向治疗(16%)。在两组患者中,17%的患者为包含EGFR突变在内的可靶向基因突变。截止至2023年03月29日数据截止日期,52例患者仍在接受Dato-DXd治疗,17例患者仍在接受多西他赛治疗。
(点开看大图)
2期研究TROPION-Lung05的初步结果显示,Dato-DXd在既往接受过多线治疗且存在包括EGFR突变和ALK重组在内的可靶向基因突变组的晚期或转移性NSCLC患者中显示出令人欣喜的抗肿瘤疗效。这些数据在2023年10月21日举行的ESMO大会以小型口头会议(1314MO)形式公布。
在总体人群(n=137)中,Dato-DXd组的ORR为35.8%(95%CI:27.8-44.4),包括CR为4例,PR为45例,疾病控制率(DCR)为78.8%。中位PFS为5.4个月(95%CI:4.7-7.0)。在携带EGFR突变的患者(n=78,患者人数最多的基因组突变)中,Dato-DXd的ORR为43.6%,DCR为82.1%。
在研究TROPION-Lung05中,最常见的3级或3级以上TRAE包括口腔黏膜炎(10%)、贫血(6%)、食欲下降(4%)和疲乏(4%)。经独立委员会裁定,5例间质性肺疾病(ILD)事件为与药物有关,包括4例1级或2级事件,和1例5级事件。
关于TROPION-Lung01
TROPION-Lung01是一项正在进行的全球、随机、多中心、开放性、3期研究,旨在评估Dato-DXd与多西他赛相比在既往接受过至少一种治疗且存在或不存在可操作基因突变的局部晚期或转移性NSCLC患者中的疗效和安全性。存在可操作基因组突变的患者既往接受过含铂化疗和获批靶向治疗。不存在已知可操作基因组突变的患者既往同步或序贯接受过含铂化疗和PD-1或PD-L1抑制剂治疗。
TROPION-Lung01的双主要终点为经BICR评估的PFS以及OS。关键次要终点包括研究者评估的PFS、ORR、DOR、达到缓解的时间、经BICR和研究者评估的DCR以及安全性。
TROPION-Lung01在亚洲、欧洲、北美洲、南美洲的研究中心招募了约600例患者。如欲了解更多信息,请访问ClinicalTrials.gov.
关于TROPION-Lung05
TROPION-Lung05是一项正在进行的全球、多中心、单臂、开放性、2期研究,旨在评估Dato-DXd治疗存在可操作基因突变且既往接受至少一种酪氨酸激酶抑制剂和至少一种含铂化疗方案(联合或不联合其他全身治疗)期间或之后出现疾病进展的晚期或转移性NSCLC患者的疗效和安全性。存在一种或多种基因突变,包括EGFR、ALK、ROS1、NTRK、BRAF、RET或MET14号外显子跳跃突变,且既往治疗线数不超过4的患者有资格参加这项研究。
主要研究终点为经BICR评估的ORR。次要疗效终点包括DOR、可测量肿瘤直径总和的最佳百分比变化、DCR、临床获益率、PFS、达到缓解的时间和OS。安全性终点包括治疗中出现的不良事件和其他安全性参数。TROPION-Lung05在全球范围内入组了约137例患者。欲了解更多信息,请访问ClinicalTrials.gov.
关于非小细胞肺癌
全世界每年有100多万人被确诊晚期NSCLC2,3。分别有大约30%和70%的NSCLC肿瘤的组织学特征为鳞状或非鳞状,后者包括腺癌和大细胞癌1。尽管免疫疗法和靶向疗法改善了一线治疗的治疗结局,但大多数患者最终还是会出现疾病进展并接受化疗4,5,6。几十年来,尽管化疗的疗效有限且存在已知的副作用,但在没有其他治疗选择的情况下,化疗一直是晚期NSCLC患者最后的治疗手段 4,5,6。
TROP2是一种在绝大多数NSCLC肿瘤细胞表面广泛表达的跨膜糖蛋白7。目前尚无TROP2靶向ADC获批用于治疗肺癌8,9。
关于第一三共和阿斯利康的合作
第一三共与阿斯利康分别于2019年3月和2020年7月达成全球合作,共同开发并商业化优赫得®和Dato-DXd,在日本市场第一三共拥有各款ADC产品的独家权益。第一三共负责优赫得®和Dato-DXd的生产和供应。
关于DatopotamabDeruxtecan(Dato-DXd)
Datopotamabderuxtecan(Dato-DXd)是一种试验用靶向TROP2的ADC。Dato-DXd采用第一三共独有的DXd-ADC技术设计,是第一三共肿瘤产品线六款ADC中的一款,也是阿斯利康ADC科学平台中最先进的项目之一。Dato-DXd由人源化抗TROP2IgG1单克隆抗体(与SapporoMedicalUniversity合作开发)通过可裂解四肽连接子与多个拓扑异构酶I抑制剂有效载荷(一种依喜替康衍生物,DXd)连接组成。
全面开发项目TROPION正在全球范围内进行,其中有超过12项研究评价Dato-DXd在多种肿瘤中的疗效和安全性,包括NSCLC、三阴乳腺癌(TNBC)和HR阳性、HER2低表达或阴性乳腺癌。除TROPION项目外,Dato-DXd还在几项正在进行的研究中作为新型联合治疗接受评估。
关于第一三共DXdADC产品组合
第一三共DXdADC产品组合目前主要有六款处于临床开发阶段的ADC药物,涵盖多种癌症类型。优赫得®(靶向HER2的ADC)和datopotamabderuxtecan(Dato-DXd,靶向TROP2的ADC)目前正由第一三共与阿斯利康共同开发并在全球范围内商业化。另外四款第一三共DXdADC包括patritumabderuxtecan(HER3-DXd,靶向HER3的ADC)、ifinatamabderuxtecan(I-DXd,靶向B7-H3的ADC)、raludotatugderuxtecan(R-DXd,靶向CDH6的ADC)以及DS-3939(靶向TA-MUC1的ADC)。
每款ADC均采用第一三共独有的DXdADC技术设计,用于靶向表达特定细胞表面抗原的癌细胞,并将细胞毒性有效载荷递送至癌细胞内部。每款ADC由单克隆抗体通过可裂解四肽连接子与多个拓扑异构酶I抑制剂有效载荷(一种依喜替康衍生物,DXd)连接组成。
Datopotamabderuxtecan、ifinatamabderuxtecan、patritumabderuxtecan、raludotatugderuxtecan和DS-3939均为在研药物,尚未在任何国家获批用于任何适应症。尚未完全确定安全性和疗效。
关于第一三共
第一三共是一家为社会可持续发展做贡献的创新型全球医疗保健公司,致力于发现、开发和提供新的标准疗法,以提高世界各地患者的生活质量。第一三共专注制药行业120余年,凭借其世界一流的科学和技术,为癌症、心血管疾病和其他医疗需求远未得到满足的疾病患者研发新的治疗方法和创新药物。如欲了解更多信息,请访问 www.daiichisankyo.com.
参考文献:
1.NationalCancerInstitute.SEERCancerStatisticsFactsheets:LungandBronchusCancer,2015.AccessedOctober2023.
2.SiegelR,etal.CACancerJClin.2021;71:7-33.
3.WorldHealthOrganization.InternationalAgencyforResearchonCancer.LungFactSheet.AccessedOctober2023.
4.ChenR,etal.JHemalOncol.2020;13(1):58
5.MajeedU,etal.JHematolOncol.2021;14(1):108
6.PircherA,etal.AnticancerResearch.2020;70(5):287-294.
7.MitoR,etal.PatholInt.2020;70(5):287-294
8.Rodríguez-AbreauDetal.AnnOnc.2021Jul;32(7):881-895.
9.AmericanCancerSociety.TargetedDrugTherapyforNon-SmallCellLungCancer. AccessedOctober2023
