印度药企称其斑秃新药已通关美国FDA,Ⅲ期试验效果喜人
财联社7月26日讯(编辑赵昊)当地时间周四(7月25日),印度最大的制药公司太阳药业(SunPharmaceuticalIndustriesLimited)发布新闻稿称,美国食品药品监督管理局(FDA)已批准了其药物“deuruxolitinib”。

据介绍,deuruxolitinib(商品名:LEQSELVI)是8毫克口服片剂,每日服用两次,用于治疗患有严重斑秃的成年人。
deuruxolitinib是一种JAK1与JAK2选择性抑制剂,可以破坏导致毛囊自体免疫攻击的信号转导,从而阻止毛囊被破坏,促进毛发再生。
在作为FDA批准依据的Ⅲ期实验中,原先平均患者头皮毛发覆盖率仅为13%。24周后,超过30%服用LEQSELVI的患者头皮毛发覆盖率达到80%或更高。
印度太阳药业高级副总裁、开发主管MarekHonczarenko表示,“我们很高兴美国FDA及时批准了LEQSELVI。这证明了我们团队有能力有效地将治疗从研发阶段推进到批准阶段,这种疗法对医生和患者都具有重大意义。”
新闻稿写道,斑秃影响着大约70万美国人,其中30万人患有严重的斑秃,常有患者对现有的治疗方法不满意,因为这些疗法进展缓慢。
太阳药业北美业务首席执行官AbhayGandhi表示,LEQSELVI提供了一种新的有效解决方案,将明显增强长期与严重斑秃作斗争的患者及其医生的选择。
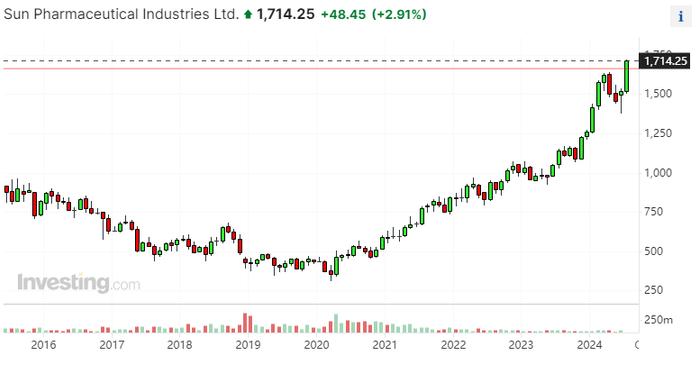
受这一消息的影响,在印度上市场的太阳药业股价收创历史新高。
不过,LEQSELVI可能引起严重副作用,包括严重感染、恶性肿瘤、血栓、胃肠穿孔和某些实验室异常,可能还存在增加死亡率和主要心血管事件的风险。
少数患者(3.1%)因不良反应而中止了服用。在安慰剂对照试验中,最常见的不良事件是头痛(12.4%,对比安慰剂组的9.4%)、痤疮(10%,对比安慰剂组的4.3%)和鼻咽炎(8.1%,对比安慰剂组的6.7%)。
