5亿美元!首款“膀胱癌基因疗法”签订对外授权协议
转自:药融圈


8月24日,RoyaltyPharmaplc(RPRX)宣布:将向Ferring支付3亿美元预付款和潜在的2亿美元里程碑付款,以换取Ferring膀胱内基因疗法Adstiladrin®(nadofaragenefiradenovec-vncg)在美国的销售特许权使用费。总计5亿美元,折合人民币36亿元(按最新汇率1美元≈7.2839人民币计算)。
根据协议条款,RoyaltyPharma将从Adstiladrin在美国的净销售额中获得5.1%的特许权使用费,在支付与生产制造相关的里程碑后,这一比例将增至8.0%。特许权使用费预计2030年中期结束。
膀胱癌是美国第六大癌症,非肌层浸润性膀胱癌(NMIBC)约占75%,具有高复发率,且可进展为高侵袭性和高转移性膀胱癌。卡介苗仍是高级别NMIBC患者的一线治疗方法,但如果患者对卡介苗无应答,除膀胱切除手术外,治疗选择非常有限。
Adstiladrin是一款基于腺病毒载体的新型基因疗法,也是首款膀胱癌基因疗法,每三个月给药一次,通过导尿管注入患者膀胱,载体进入膀胱壁细胞,导致细胞分泌大量可对抗癌症的干扰素α-2b蛋白。这种新型基因疗法将患者自身的膀胱壁细胞转变为干扰素微工厂,从而增强人体对癌症的天然防御能力。
Adstiladrin的一项III期临床试验显示:157名患者,经过12个月治疗后,51%的患者实现了完全缓解,缓解的中位持续时间为9.7个月,其中有46%的患者在至少1年的时间内保持完全缓解。由此可见,Adstiladrin对于膀胱癌的治疗提供了新的选择。
2022年12月16日,美国FDA批准Adstiladrin上市,用于治疗卡介苗无响应的高风险NMIBC患者,这些患者伴有原位癌,可能携带或不携带乳头状肿瘤。该产品目前仅获准在美国使用。
2023年4月,FDA批准Adstiladrin的生物制剂许可申请(BLA)的事先批准补充(PAS),从而扩大了原料药生产规模。
Ferring泌尿肿瘤特许经营业务全球负责人BipinDalmia 表示:“该领域几十年来进展甚微,Adstiladrin为高危NMIBC患者提供了创新治疗。此次合作,将推动Adstiladrin成为泌尿肿瘤领域的重磅药物。”
RoyalPharma
RoyaltyPharma成立于1996年,是生物制药特许权使用费的最大买家,也是生物制药行业创新的领先资助者。与来自学术机构,研究医院和非营利组织的创新者(通过中小型生物技术公司到全球领先的制药公司)合作。该公司收集了一系列特许权使用费,使他们有权直接基于许多行业领先疗法的顶线销售进行付款,包括Imbruvica,Januvia,Kalydeco,Trikafta,Truvada,Tysabri和Xtandi。该公司直接或间接地为生物制药行业中的创新提供资金,当他们与公司合作共同资助后期临床试验和新产品上市以换取未来的特许权使用费时,以及当他们从原始创新者那里获得现有的特许权使用费时,就间接地为生物制药行业的创新提供资金。
FerringPharmaceuticals
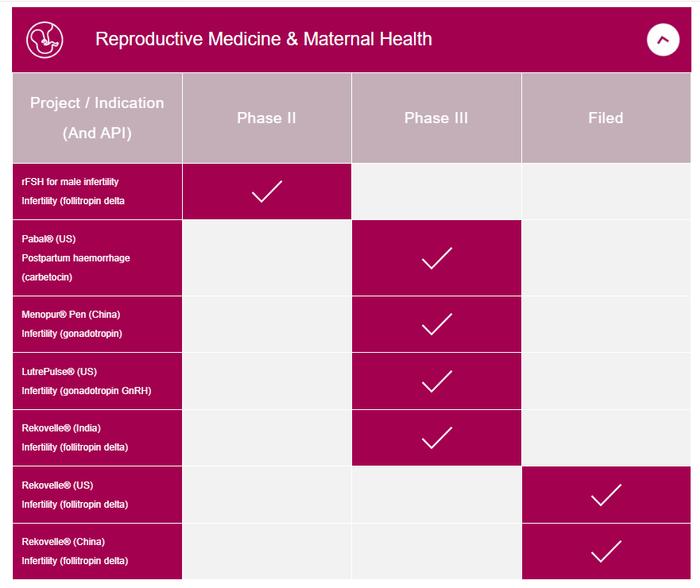
Ferring是一家私营企业,成立于1950年,目前在全球拥有约7,000名员工,在50多个国家拥有子公司,其产品销往100个国家。它是生殖医学、妇产科、胃肠道疾病以及泌尿科专业领域的领导者。50多年来,Ferring一直致力于开发针对母亲和婴儿的治疗方法,并拥有涵盖从受孕到分娩的治疗组合。
参考资料:
https://www.royaltypharma.com/news-releases/news-release-details/royalty-pharma-and-ferring-pharmaceuticals-enter-us-500-million
