【征求意见】药物临床试验不良事件评价指导原则
转自:蒲公英Ouryao
2023年09月26日,为了更好地开展药物临床试验期间安全性研究与风险管理工作,国家药监局审评中心发布了《药物临床试验不良事件相关性评价技术指导原则(征求意见稿)》,征求意见时限为自发布之日起1个月。

01 重点内容
1、制定本指导原则的目的是在国内外相关研究基础上,进一步规范我国药物临床试验中不良事件与试验药物相关性评价方法与标准,为药物临床试验申办者、研究者、监管机构及其他相关人员开展药物临床试验中不良反应监测、识别、评估与控制相关工作提供借鉴与参考,以更好地践行临床试验风险最小化,保护受试者安全。
2、准确评价临床试验不良事件与试验药物的相关性,可能受到多方面因素的影响和制约,包括病例信息资料的不完整或存在偏性、评价者专业背景知识的限制等,常见的考虑因素包括以下:
试验药物暴露(暴露时间、暴露剂量)
试验药物代谢动力学特征
试验药物药理作用
试验药物非临床安全性结果
试验药物前期已有安全性研究结果
疾病因素
合并用药及其他治疗
受试者特征及其他特殊情况;
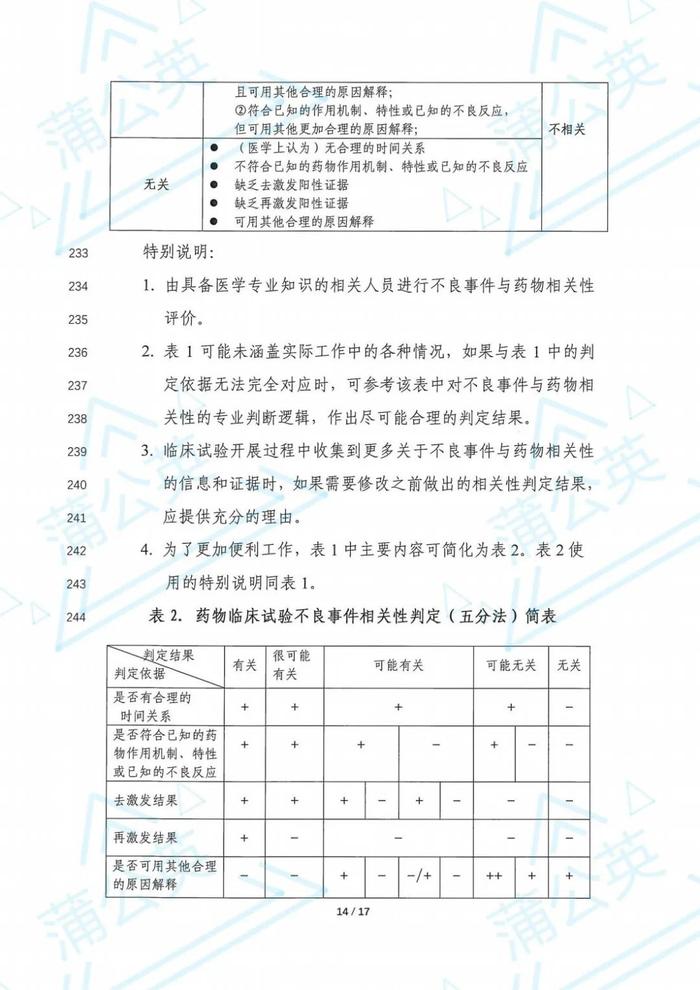
3、药物临床不良事件评价原则包括
时序性、合理性、剂量-暴露-反应关系、实验/试验证据支持、可重复性、特异性、类比、一致性、
4、药物临床不良事件评价要点包括
用药与不良事件的出现有无合理的时间关系;
不良事件是否符合该药物已知的作用机制、特性或已知的不良反应;
去激发结果(如适用);
再激发结果(如适用);
不良事件是否可用受试者病情进展(包括伴随疾病)、合并用药的作用、其他治疗措施或干扰因素的影响来解释。
02 通知原文
为了更好地开展药物临床试验期间安全性研究与风险管理工作,进一步明确相关技术标准,我中心组织起草了《药物临床试验不良事件相关性评价技术指导原则》,经工作组及中心内部讨论,已形成征求意见稿。
我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。
征求意见时限为自发布之日起1个月。
您的反馈意见请发到以下联系人的邮箱:
联系人: 裴小静,刘敏
联系方式:peixj@cde.org.cn;lium02@cde.org.cn
03 指导原则(征求意见稿)原文