司美格鲁肽一骑绝尘,礼来III期头对头PK,口服小分子机会有多大?
转自:一度医药
近年来,GLP-1领域药物的持续突破,使之成为继PD-1后行业聚焦的明星赛道,司美格鲁肽口服剂型的上市,更是成为了该领域的里程碑事件。至此,寄希望于安全性、疗效、依从性等方面进行优化,“后GLP-1RA”已很难居上。故有研究者将目标锚定传统小分子,希望在安全有效的基础上,同时收获依从和可支付特点。基于此,当前已有品种(礼来/LY350297)进入到临床III期,且正在头对头正面硬刚司美格鲁肽(口服),非常值得关注。同时,该临床结果也势必会影响到该赛道的整体走势(尤其是国内)。

GLP-1类药物全球研发概况
司美格鲁肽,作为明星品种被人们熟知,但并非首个GLP-1类药物(或GLP-1RA)。
全球首个获批上市的GLP-1类药物为阿斯利康开发的艾塞那肽(2005/FDA),后依次为诺和诺德的利拉鲁肽(2010/FDA)、阿斯利康的长效艾塞那肽(2012/FDA)、葛兰素史克的阿必鲁肽(2014/FDA)、礼来的杜拉鲁肽(2014/FDA)、赛诺菲的利西那肽(2016/FDA)、上海仁会生物制药的贝那鲁肽(2016/CFDA)、诺和诺德的司美格鲁肽(2017/FDA、2019/FDA/口服)、瀚森的聚乙二醇洛塞那肽(2019/CFDA)等。
诺和诺德官网对该品种的信息披露

一直以来,GLP-1类药物总体的优化方向主要有以下2点:1)给药周期由2-3次/天,逐渐演变为1次/周;2)给药方式由注射变为口服。
技术方面,长效主要有以下途径:1)改变第8位氨基酸,阻止DPP-IV剪切;2)引入脂肪酸链,结合白蛋白,以减缓肾清除,or通过GLP-1与白蛋白等大分子融合,or与PEG共价结合,其目的还是减缓肾消除;3)通过皮下缓释来维持血药浓度。口服主要为:司美格鲁肽的SNAC技术。
市场方面,2022年司美格鲁肽销售额全球位列第13位,共计84.65亿美元,已完全处于该领域的头部地位;另,礼来公司的度拉糖肽为74.40亿美元;以上2个品种占据了GLP-1类药物全球98%市场份额。
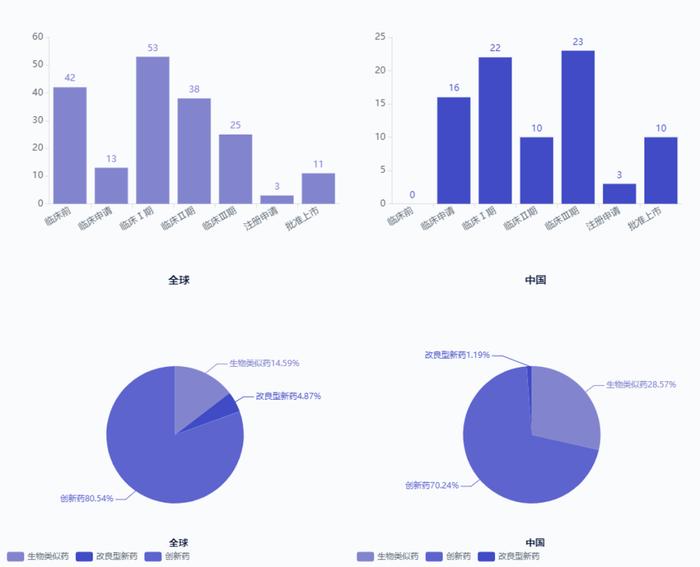
研发方面,除上述已上市药物外,全球处于注册阶段品种3款,临床III期的品种共计25款,临床II~I期品种合计91款;国内,除已上市品种,注册阶段品种3款,临床III期品种23款,临床II~I期品种32款,临床申请16款。
由此可见,该赛道已非常拥挤,后来者若无“显著的临床优势”,且不说能否超车,大概率很难获批。那么,优势从何而来,部分研究者将方向转移至真正意义的传统小分子,以期从小分子客观存在的优势来做出产品的差异化和临床优势。
全球/国内GLP-1 RA药物研发概况

礼来(LY3502970)-III期临床正面硬刚
司美格鲁肽实现了口服,绝对是GLP-1类药物开发的里程碑事件,但对于口服给药,尤其是依从性更好的口服给药,无疑还是小分子擅长的领域。自从GLP-1多肽药物进入临床开发后,小分子药物一直紧随其后,虽然在这期间也伴随着失败的发生,但曙光已现。前不久,礼来公司的Orforglipron(LY3502970),III期临床选择头对头PK司美格鲁肽(口服),其最终临床数据势必会影响GLP-1口服小分子的总体走向。下面来介绍下Orforglipron这个品种。
Orforglipron(LY3502970/OWL833),该品种原研公司为中外制药株式会社,是一种口服非肽类GLP-1受体激动剂(食蟹猴体内的生物利用度为21%-28%)。2018年9月,中外制药将OWL833的全球开发和商业化权利授权给礼来公司(LY3502970)。当前,该品种于全球和中国的最高阶临床均为Ⅲ期,适应症覆盖GLP-1RA经典的糖尿病、肥胖等等。
Orforglipron(LY3502970)不同适应症进展

公开信息显示,该品种于2019年进入临床I期,在评价安全性的主要背景下将早期的适应症锚定Ⅱ型糖尿病。2021年进入临床II期,并同时开展糖尿病和肥胖的适应症研究;II期临床(减重适应症),45mg的Orforglipron剂量组治疗36周减重14.7%,相比安慰剂减重12.4%。II期(糖尿病适应症),Orforglipron治疗26周糖化血红蛋白(Hb1Ac)降低2.1%,安慰剂和度拉糖肽组分别降低0.43%和1.10%,减重则达到10.1kg,安慰剂和度拉糖肽组分别减重2.2kg和3.9kg。2023年3月进入到临床III期;总体上,临床进展非常快。
Orforglipron临床Ⅱ期结果

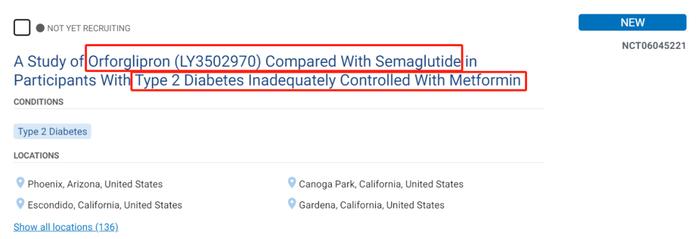
2023年9月21日,一项随机、开放标签、头对头的III期试验(NCT06045221)登记,预计在美国、中国、日本等国家和地区启动,以评价Orforglipron(LY3502970)和口服司美格鲁肽在2型糖尿病患者(二甲双胍控制不佳)体内的疗效和安全性,主要终点为Hb1Ac的变化。该临床试验的设定及启动,足见研发公司礼来对Orforglipron(LY3502970)临床价值与临床潜力的自信。
Orforglipron(LY3502970)临床试验登记

口服小分子GLP-1RA研究进展
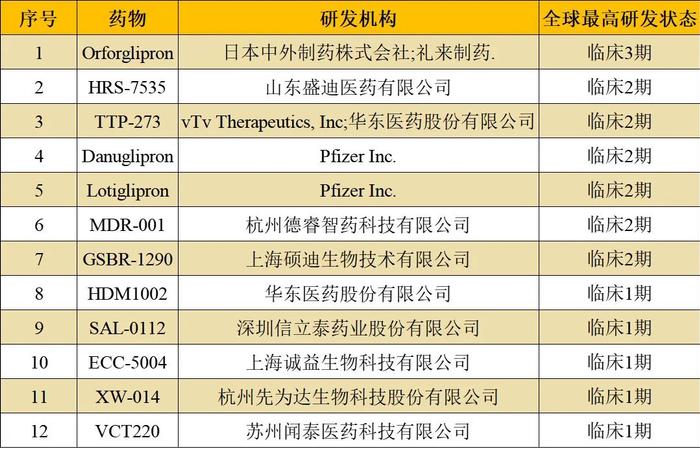
随着GLP-1领域药物的市场高走,小分子药物凭借其客观的优势,吸引了众多研发机构投入其中,而国内新药研发企业,不论是通过项目引进的方式还是通过自研的手段,自然不会错过对该领域的竞争。当前,该领域国内开发企业主要有山东盛迪、华东医药等,国外除礼来、日本中外制药,还有辉瑞、vTvTherapeutics等。
全球开发的口服GLP-1R小分子激动剂举例
下面对部分品种细述如下:
►HRS-7535
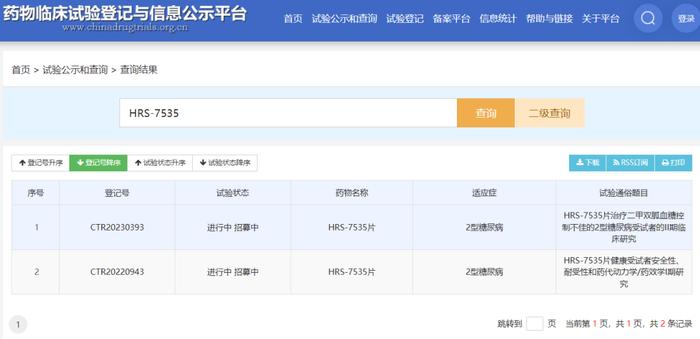
该品种申请人为山东盛迪医药有限公司,口服片剂,当前临床试验主要用于2型糖尿病的治疗。2022年1月,国内完成IND申请,3月获默示许可,12月提补充申请,2023年4月再提补充申请,当前最高临床阶段为临床II期。
国内临床登记号CTR20230393,试验专业题目“HRS-7535片治疗二甲双胍血糖控制不佳的2型糖尿病受试者的有效性和安全性的II期临床研究(多中心、随机、双盲、安慰剂对照、平行设计)”,试验目的为“评价治疗16周后,HRS-7535片相较于安慰剂治疗二甲双胍控制不佳的2型糖尿病受试者中的有效性和安全性,包括HbA1c、空腹葡萄糖、体重等有效性指标的变化及不良事件、低血糖事件等安全性指标”。
HRS-7535/国内临床登记信息
►TTP-273 & HDM1002
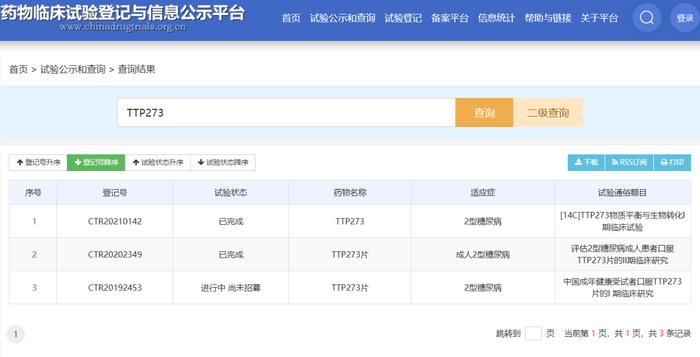
TTP273,是华东医药于2017年12月引进美国vTvTherapeuticsLLC(简称“vTv公司”)的全球创新口服小分子GLP-1R激动剂,vTv公司独家许可华东医药于中国大陆、香港和澳门特别行政区、台湾地区、韩国、澳大利亚及东盟十国共16个国家和地区进行TTP273产品的开发、生产及商业化。当前该品种最高临床阶段为II期。
之后,华东医药将TTP273授予DaewonPharmaceuticalCo.,Ltd在韩国的独家开发、生产及商业化权益。公告称,Daewon将向华东医药支付150万美元首付款,以及最高可达3750万美元的开发、注册及销售里程碑付款,和约定比例的净销售额提成费。
另外,基于对TTP273该品种的开发经验,华东医药还有另一款自主研发的小分子GLP-1受体激动剂HDM1002,已于2023年2月递交中国IND申请,并于2023年4月完成美国IND申请递交。而基于研发规律,HDM1002品种具备临床更优的潜力极大。
TTP273 国内临床登记信息
►Lotiglipron &Danuglipron
Lotiglipron(PF-07081532)和Danuglipro(PF-06882961),这两个品种的开发公司均为辉瑞,辉瑞在传统小分子GLP-1RA药物的开发方面,投入较大。
Lotiglipron,2019年进入临床,早期临床数据显示Lotiglipron具备一定的血糖控制和减重疗效,且具备相对的安全性和耐受性。2022年在第58届EASD年会上公开了该品种同安慰剂对照的HbA1c变化数据。之后,相继进行了C-14和DDI方面的临床试验。2022年10月,一项针对糖尿病和肥胖的II期临床试验启动,临床试验数据披露,部分受试者发生转氨酶升高。
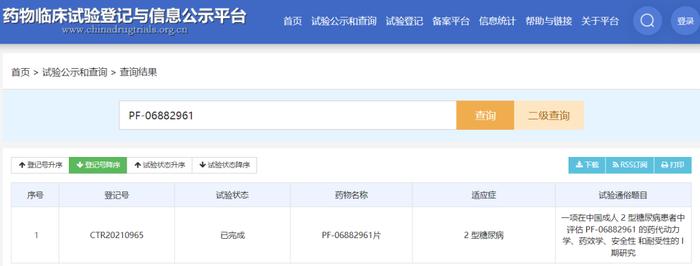
Danuglipron,2017年进入临床,当前最高临床阶段为临床II期。2020年第80届ADA年会公开数据证实其达到主要终点,安全耐受,而最常见的AEs是胃肠道反应。同安慰剂比较,HbA1c显著降低,且随剂量增加,体重显著降低。2021年1月,在中国申请IND,试验专业题目为“在中国成人2型糖尿病患者中评估PF-06882961的药代动力学、药效学、安全性和耐受性:一项为期8周的随机、双盲、申办方开放、安慰剂对照I期研究”。试验主要目的为“分析中国成人2型糖尿病受试者在第1天单剂口服给药后和后续多剂口服给药后PF-06882961的血浆PK特征。次要目的为“评价中国成人2型糖尿病受试者在第1天单剂口服给药后和后续多剂口服给药后PF-06882961的安全性和耐受性”。
Danuglipron 国内临床登记信息

小结与展望
口服小分子,尤其是非肽类的GLP-1RA的开发,不仅符合创新药研发规律,同时更符合当下的新药研发要求。当然,这类药物的开发存在一定的技术难度,且风险较高。礼来公司敢于III期头对头碰司美格鲁肽,相信其已经具备了一定的数据底气,以期夺取诺和诺德在GLP-1领域的市场份额。如若成功,不仅可塑造一个重磅炸弹品种,同时也将为我国该领域的新药审批做好铺垫,促进国内新药加速上市。这里值得思考的是,创新药品种差异化和临床价值的挖掘,需要越来越多的思考和深耕,才有可能满足当下大环境下的极为严苛的新药研发要求。
向下滑动查看全文:
参考资料:
1. 药智数据
2.https://www.novonordisk.com.cn/content/dam/nncorp/cn/zh_cn/ir-materials/pdfs/2023/2023032701.pdf
3.https://vip.yaozh.com/globaldrugs/analysis?targets=GLP-1R
4.https://clinicaltrials.gov/search?cond=NCT06045221
5.http://www.chinadrugtrials.org.cn/clinicaltrials.searchlist.dhtml
6.http://www.chinadrugtrials.org.cn/clinicaltrials.searchlistdetail.dhtml
7.华东医药股份有限公司关于签署TTP273产品独家授权许可协议的公告.华东医药股份有限公司董事会2021年9月29日.
8.http://www.chinadrugtrials.org.cn/clinicaltrials.searchlist.dhtml
作者:咖啡与茶与药
主编:小宝
