18F-LNC1007注射液将于近期在澳大利亚开展I期临床试验
转自:东诚药业
5月2日,东诚药业集团下属公司蓝纳成新加坡子公司收到美国食品药品监督管理局核准签发的关于18F-LNC1007注射液的药品临床试验批准通知书,将于近期在澳大利亚开展I期临床试验。
关于18F-LNC1007注射液
01
公司在研产品18F-LNC1007注射液是一种新型双靶点放射性体内诊断药物,同时靶向成纤维细胞活化蛋白(FibroblastActivationProtein,以下简称“FAP”)和整合素αvβ3(Integrinαvβ3,以下简称“αvβ3”),拟用于诊断FAP和αvβ3阳性的成人实体瘤。
02
FAP为II型跨膜丝氨酸蛋白酶,高表达于许多上皮肿瘤相关成纤维细胞(Cancer-AssociatedFibroblasts,简称“CAF”)中,包括胃癌、食管癌、肺癌、结直肠癌、卵巢癌等,而在正常组织、良性肿瘤间质中无表达或表达较低。αvβ3是位于细胞表面的异源二聚体受体,在正常血管内皮和上皮细胞很少表达,但在肺癌、骨肉瘤、成神经细胞瘤、乳腺癌、前列腺癌、膀胱癌、胶质母细胞瘤及浸润性黑色素瘤等多种实体肿瘤细胞表面有高水平表达,表明αvβ3在肿瘤生长、侵袭和转移过程中起着关键作用。
03
双靶向FAP和αvβ3的18F-LNC1007注射液可以进一步提高肿瘤的诊断效率,在临床前研究和临床转化研究中,18F-LNC1007注射液能够显著延长肿瘤摄取时间、提升肿瘤靶向效率,并具有良好的肿瘤成像质量。有希望在未来成为一种非侵入性示踪剂用于FAP和/或αvβ3阳性表达患者的临床诊断。
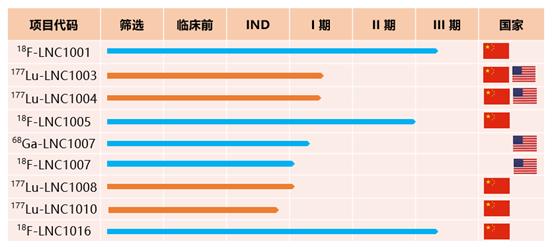
蓝纳成迄今已有涉及4个靶点共9款诊疗一体化创新核药,在中美分别处于临床试验或IND审评阶段,共计获得13项临床试验批件;5款诊断核药:2款处于III期临床试验,2款处于I期临床研究阶段;4款治疗核药:3款处于I期临床研究阶段,1款处于IND审评阶段。
关于蓝纳成
蓝纳成是由东诚药业与国际顶级分子影像及纳米医学领域专家陈小元教授于2021年联合创立的,专注于全球领先的1类诊疗一体化创新肿瘤核药研发平台的打造,致力于为肿瘤患者提供更加精准和有效的治疗方案,推动核医学在全球的发展。(烟台蓝纳成生物技术有限公司网址:https://www.dc-lnc.com/)
