Nature | 首次构建出肿瘤中T细胞表达的转录因子图谱,有望开发出更好的癌症免疫疗法
转自:生物谷
T细胞是免疫系统中参与杀死癌症的关键成分。肿瘤产生的信号会关闭这些T细胞,部分上是通过迫使它们逐渐分化(成熟)为一种功能低下的状态,即衰竭。
在一项新的研究中,来自美国圣犹达儿童研究医院的研究人员全面研究了癌症中T细胞分化状态所涉及的转录因子。然后,他们利用这些信息在临床前模型中通过促进或阻止T细胞分化来增强抗癌活性。这些研究结果对癌症免疫疗法具有重要意义。相关研究结果于2023年11月15日在线发表在Nature期刊上,论文标题为“Single-cellCRISPRscreensinvivomapTcellfateregulomesincancer”。

过继细胞疗法(adoptivecelltherapy,ACT)中使用的T细胞用于靶向杀死癌细胞。作为ACT之一的嵌合抗原受体(CAR)T(CAR-T)细胞疗法对血癌有临床疗效,但对实体瘤的疗效不佳。这种疗效上的差异部分是由于肿瘤促进了T细胞衰竭,从而使得T细胞主动杀灭癌细胞的效率降低。这些作者发现,他们可以精确地打断T细胞分化过程,从而提高抗肿瘤疗效。
论文通讯作者、圣犹达儿童研究医院免疫学系博士HongboChi说,“T细胞是肿瘤免疫疗法的基石,我们找到了一种对T细胞进行重编程的新方法,使它们更加有效。我们可以将它们推向一种特化状态,使它们成为功能更强的肿瘤杀伤细胞。”
改变分化,使得T细胞成为杀癌T细胞
从概念上讲,T细胞分化类似于一条从山上流下的河流。山顶是前体细胞,山底是衰竭细胞。理想的状态是介于这两个极端之间,就像山中间有一个湖,分化得足够但不过度,从而具有高增殖性和有效的抗癌活性。湖泊的水来自上方,但也有一条溪流源源不断地将湖泊中的沿着山坡流下。如果不间断,湖中所有的水最终都会通过这条溪流排出,所有的T细胞都会衰竭。
这些作者找到了一种方法,可以增加来自上方的水流,并在湖泊下方的溪流中筑坝,从而使湖泊中积聚更多的水,或者更贴切地说,使更多的T细胞有效杀死肿瘤。例如,当他们剔除转录因子ETS原癌基因1(ETS1)时,通过加强向中间状态的分化(增加流入湖泊中的水流量),增加了杀死癌症的T细胞数量。
另一方面,敲除转录因子免疫球蛋白kappaJ区重组信号结合蛋白(RBPJ)可通过阻断终末分化(在湖泊下方的溪流中筑坝)来增加中间状态T细胞的积累。每种方法都能显著提高抗肿瘤活性。
更有希望的是,当这些作者将他们改造过的T细胞与一种称为免疫检查点阻断的免疫疗法相结合时,他们进一步提高了抗肿瘤活性。
论文共同第一作者、圣犹达儿童研究医院免疫学系博士PeipeiZhou说,“我们为增强免疫疗法提供了新的潜在策略。我们通过让上游前体细胞分化出杀癌T细胞来增加它们的数量,我们还可以阻断终末分化来增加这些功能性T细胞的积累。这两种方法都提高了在我们的免疫检查点阻断模型中的抗肿瘤疗效。”
虽然这项新的研究是在小鼠模型中完成的,但是这些作者利用来自人类临床样本的生物信息学数据验证了这些基因在人类的这些过程中同样重要。
绘制衰竭T细胞的分化历程图
T细胞渗入肿瘤以启动它们摧毁肿瘤的任务。这些作者绘制了渗入肿瘤的T细胞中表达的转录因子图谱。他们的研究显示了哪些转录因子及其网络负责每种T细胞分化状态,为改进免疫疗法提供了新的靶标。
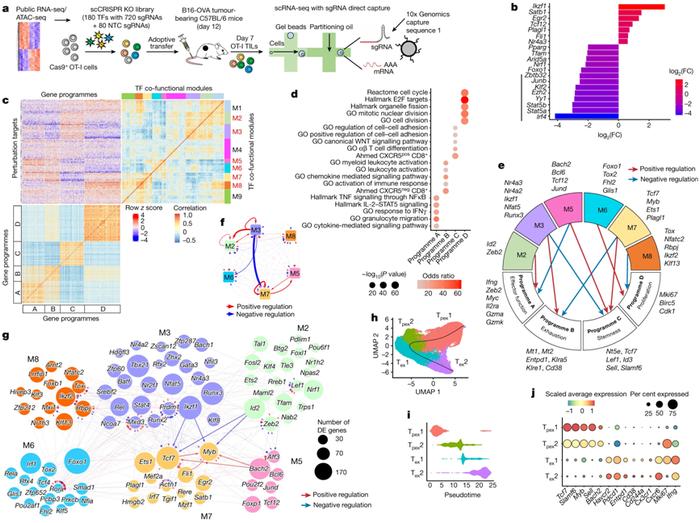
论文共同第一作者、圣犹达儿童研究医院免疫学系博士HaoShi说,“基于高维功能缺失基因筛选,我们构建了肿瘤中T细胞分化和耗竭领域的转录因子图谱。该图谱将为未来的科学家们提供参考指南,用于确定改进基于T细胞的免疫疗法的方法。”
过去理解T细胞衰竭的尝试主要集中在单个转录因子上,而这次筛选则更加全面。这使得这些作者能够记录所涉及的整个基因调控网络。Zhou说,“我们提供了有史以来最完整的肿瘤内T细胞转录因子图谱。”Shi补充说,“这样的一种因果转录因子网络为研究生物学的基本过程---谱系分化---提供了新的视角。”
这些作者利用单细胞CRISPR-Cas9筛选技术完成了这一壮举,其中CRISPR-Cas9是一种基因编辑技术,在全面筛选中选择性地去除转录因子后,分析单个细胞的基因表达谱。转录因子是直接调控基因表达的蛋白。通过研究单个T细胞的基因表达模式,他们可以对它们进行比较,看看哪些被敲除的转录因子对T细胞的分化和抗癌活性影响最大。
Chi说,“同样的方法可能更广泛地适用于T细胞和免疫学以外的许多生物学领域,以增加我们的知识。我们展示了这种新技术,即体内单细胞CRISPR筛选,可以推动新的生物学发现。我认为我们正处于真正激动人心的时刻。”
参考资料:
PeipeiZhouetal.Single-cellCRISPRscreensinvivomapTcellfateregulomesincancer.Nature,2023,doi:10.1038/s41586-023-06733-x.
ScientistsidentifyT-celldifferentiationnodestoimprovecancer-killinghttps://medicalxpress.com/news/2023-11-scientists-t-cell-differentiation-nodes-cancer-killing.html
