以多年的注册经验复盘化药制剂生产工艺信息表的撰写规范
转自:药事纵横
一、概述
工艺信息表是监管机构对已上市产品实施上市后监管的主要依据,随着药品批准文号一并核发,其重要性不言而喻。本文以笔者多年的注册经验来复盘化药制剂生产工艺信息表的撰写规范,对注册过程中常出现的问题进行汇总并加以批注,以期对各位同仁有所启示和帮助,助力大家更好更规范地撰写化药制剂生产工艺信息表。
二、化药制剂生产工艺信息表复盘

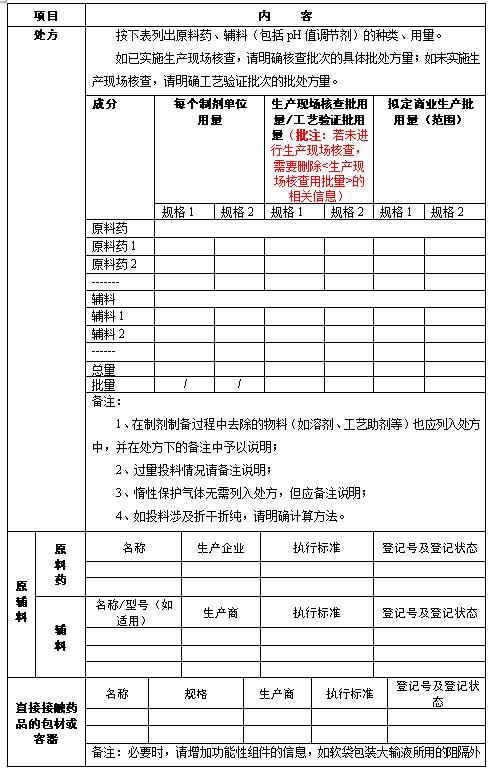

注:
1)列表明确关键工艺步骤及工艺参数的信息,作为生产工艺信息表附件。
批注:此部分内容需结合首轮申报资料及发补完善要求进行撰写,同时要与申报资料保持一致,不可随意修改。
2)原辅料的内控标准和分析方法作为生产工艺信息表附件。
对于原料药的内控标准,请按现行版中国药典格式规范整理。如原料药关联申报或已有文号,请明确本文件中的内控标准与原料药注册标准的异同,如有差异,请列表对比说明,对比内容应包括项目、方法(类型)及限度,突出显示不一致之处,并给出不一致项目(包括分析方法及增订项目)的规范文字描述。
对于辅料的内控标准,如执行现行版中国药典标准,仅需在表格的执行标准中说明即可,无需列出详细内容;如与现行版中国药典标准不完全一致,请列表对比辅料内控标准与现行版中国药典标准的异同,对比内容应包括项目、方法(类型)及限度,突出显示不一致之处,对于不同于现行版中国药典标准的项目(包括分析方法及增订项目),请按现行版中国药典格式提供规范的文字描述。
对于进口制剂,所用原料药(如不在中国市场单独销售)的质量标准及分析方法的格式可与申报资料保持一致。所用辅料的质量标准如与现行版USP/EP等一致,仅需在表格的执行标准中说明即可,无需提供标准全文;如不完全一致,请列表对比异同,对比内容应包括项目、方法(类型)及限度,突出显示不一致之处,并给出不一致项目(包括分析方法及增订项目)的规范文字描述。
批注:原辅包内控标准书写示例如下所示:
示例1
原辅包名称
内控标准
原料药
与原料药注册标准
辅料A
执行现行版中国药典
辅料B
执行现行版中国药典
辅料C
执行现行版中国药典
示例1中所示的是处方中所用原料药与辅料内控标准均与注册标准或中国药典一致的情况,此种情况下,可以只列上述表格就行,无需再进一步赘述其详细的内控标准。这样生产工艺信息表就会更加简洁明了。
示例2
原辅包名称
内控标准
原料药
与原料药注册标准不完全一致
辅料A
与现行版中国药典不完全一致
辅料B
与现行版中国药典不完全一致
辅料C
与现行版中国药典不完全一致
示例2中所示的是处方中所用原料药与辅料内控标准与注册标准或中国药典不完全一致的情况,此种情况下,只需详细描述不一致项目的内控标准即可,按照现行版中国药典的格式进行规范撰写。
示例3(针对进口制剂)
原辅包名称
内控标准
原料药
与原料药注册标准一致或详细规范描述原料药内控标准
辅料A
执行USP或EP
辅料B
执行USP或EP
辅料C
执行USP或EP
对于进口制剂,所用原料药如不在中国市场单独销售,需详细规范描述原料药的内控标准;如原料药与制剂关联审评,且关联审评已通过,此时原料药内控标准执行注册标准的话,仅需在表格的内控标准中说明即可,无需提供标准全文。
对于进口制剂,所用辅料的质量标准如与现行版USP/EP等一致,仅需在表格的内控标准中说明即可,无需提供标准全文;如不完全一致,需列表对比异同,并给出不一致项目(包括分析方法及增订项目)的规范文字描述。
3)关键中间产品(如适用)的质量标准和分析方法作为生产工艺信息表附件。
批注:对产品质量有显著影响的中间产品需制定合理的中间体内控标准,并以中国药典格式详细描述中间体质量标准。
4)制剂的放行标准作为生产工艺信息表附件。
批注:如放行标准与注册标准一致,简单说明即可;如不完全一致,需列表对比放行标准与注册标准的异同,对比内容应包括项目、方法(类型)及限度,突出显示不一致之处。对于不同于注册标准的项目(包括分析方法及增订项目),需按现行版中国药典格式提供规范的文字描述,与注册标准一致的项目无需赘述。
三、小结
工艺信息表中的所有信息均需与申报资料保持一致,不可随意更改。以上批注均是笔者的经验之谈,希望对读者有一定的借鉴作用,帮助大家能更好更规范地撰写化药制剂生产工艺信息表,缩短注册过程中与监管机构来回沟通修改完善所需的时间,助力产品快速获批。
参考文献
1.化药制剂生产工艺信息表。
