治疗糖尿病的“大杀器”:胰岛微囊化技术
罗洪焱 陈科
近年来,糖尿病发病率呈上升趋势,药物降糖具有一定疗效,但仍存在血糖波动的危险,1型糖尿病(T1DM)的临床治愈仍难以实现。作为一种免疫隔离的策略,相较于胰岛移植技术可能造成的胰岛功能下降的隐患,包裹胰岛的微囊囊材能有效隔离免疫炎性因子,因此,胰岛微囊化成为治疗T1DM的最佳策略。
近日,瑞士弗里堡大学医学院雷欧•碧勒教授团队、电子科技大学附属医院·四川省人民医院器官移植研究所王轶研究员团队为国际免疫学会联合会的官方期刊共同撰写了1型糖尿病治疗的新进展的综述文章。该综述在综合近年来已发表的各类胰岛包囊实验文章的基础上,展望了胰岛细胞包囊技术未来的发展方向。胰岛细胞包囊技术如何用于糖尿病的治疗?该技术在治疗疾病时有哪些优点?未来还有哪些需要探索的?日前,专家对相关问题进行了解读。
“胰岛胶囊”为糖尿病治疗提供新策略
提起糖尿病,人们都不陌生,作为一种尚无完全根治方法的疾病,其对于眼、肾、心脏、血管、神经造成的慢性损害和功能障碍十分严重。其中,1型糖尿病(T1DM)是一种自身免疫性疾病,T1DM患者胰腺中分泌胰岛素的胰岛β细胞,被自身免疫系统攻击而死亡,从而导致胰岛素分泌量不足、血糖升高。
目前,医学界主要采用胰岛移植的方式,通过超声引导将供体胰岛移植至受体肝门静脉内,从而替代受损的胰岛β细胞,为T1DM的治疗提供有效方法。然而,胰岛移植虽能较为长期且有效地调控血糖并降低糖尿病并发症的出现,但免疫系统仍然不放过胰岛β细胞,从而导致移植胰岛的功能可能会随着时间的流逝而逐渐下降。
“由于包裹胰岛的微囊囊材能有效隔离免疫炎性因子,因此,胰岛微囊化成为治疗T1DM的最佳策略。”王轶说。
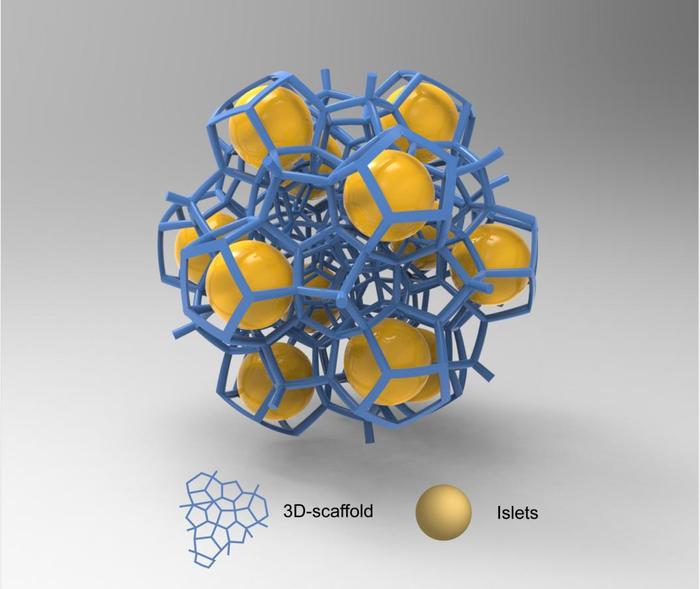
何为胰岛微囊化技术?“较为通俗的理解就是用类似于药物胶囊制剂的外壳材料将胰岛包裹起来,做成一个‘胰岛胶囊’,这样胶囊中的胰岛能免受免疫系统的攻击,同时又能很好地释放胰岛素,从而调节糖尿病患者的血糖。”王轶解释说,这一技术也称之为胰岛封装技术,实际上是一种免疫隔离的策略。
虽然胰岛被“裹上”了一层外壳,但胰岛微囊化可充分模拟天然胰岛的微观和宏观环境。
胰岛微囊化技术通过微囊造粒机将生物相容性材料包裹在胰岛外层,形成纳米级厚度的小微囊。植入的胰岛与机体形成免疫隔离屏障,允许葡萄糖、氧气、营养物质、代谢废物和信号分子的通过膜双向扩散,同时阻止免疫细胞、免疫活性物质等对移植细胞的攻击。
“这项技术在临床应用方面有许多优势,除了能解决供体短缺的问题,还能通过减少或消除排斥反应,避免移植的胰岛丢失。”王轶表示,相比于未封装的胰岛,微囊封装的胰岛具有一定的机械性能,也便于移除,避免失去功能的移植物残留在体内所致的伤害。
两种水凝胶材料结合达到优化效益
胰岛封装技术(即胰岛微囊化技术)的发展,得益于封装材料的不断改进。作为一种“细胞胶囊外壳”,封装材料的孔隙、特性和成分对于创建保形封装的胰岛具有重要作用。
“材料的孔隙必须是最佳尺寸,以便它们允许营养交换但防止免疫反应的发生。”王轶说,有机代谢物的直径在0.05~1纳米之间,而球状蛋白质的直径在2~10纳米之间,因此包囊材料的孔径应达到10纳米,以便于小分子和大分子的扩散,例如氧气、营养物质和生长因子。
目前,包囊水凝胶材料主要分为天然水凝胶与合成水凝胶。
天然聚合水凝胶主要包括多糖(藻酸盐、琼脂糖、壳聚糖等)和多肽(胶原蛋白和聚L-赖氨酸)。王轶说,海藻酸盐是第一种用于微胶囊化的材料,并且仍然是最受欢迎的微囊化材料。但由于其提取自海洋褐藻类生物,残留的杂质蛋白、多酚、内毒素等杂质,会影响材料生物相容性,成为制约临床应用的主要因素。
“天然聚合物制备的水凝胶具有良好的生物相容性和较低的生产成本,但在生理条件下,其稳定性较弱。”她说,相比于天然水凝胶,合成水凝胶(如聚乙二醇、聚甲基丙烯酸甲酯)可在孔径大小、机械强度和弹性等方面,实现对材料性能的控制,使得合成水凝胶具有更高的适宜的孔隙、机械阻力和弹性,从而持久性增加、应用范围更广,但劣势在于生物相容性低和生产成本高。
两种材料各有其优劣,是否能各取所长,达到一加一大于二的效果?王轶说,目前科学家正尝试通过天然水凝胶和合成水凝胶的结合,在改善天然水凝胶的不足的同时,保持它们的有益性质。这也是“胰岛胶囊”技术目前研究攻关的方向之一。她说,目前已有的尝试包括在海藻酸盐囊材的表面涂有甲氧基聚乙二醇(mPEG),以降低免疫反应;通过聚L-鸟氨酸(PLO)聚乙二醇化修饰海藻酸盐微囊化的胰岛,可具有较低的免疫反应和较长的胰岛体内存活时间;在聚乙二醇(PEG)水凝胶中加入寡肽RGD,可降低免疫排异反应;PLGA(聚乳酸-羟基乙酸聚合物)纳米纤维与FTY720(一种促进血管形成的小分子)或者VEGF结合,也可诱导移植胰岛的血管形成,改善移植胰岛的缺氧状态。
新的封装技术或成未来探索方向
1994年,黄馨祥研究团队报道了世界上首例微囊化人胰岛移植,一名糖尿病患者在同种异体肾移植术后,接受了海藻酸盐-聚-l-赖氨酸-海藻酸盐微囊化胰岛腹膜内移植(10,000IEQ/kg),并在胰岛移植术后6个月再次输注封装的胰岛(5000IEQ/kg)。但该患者在移植后9个月内一直未能实现胰岛素独立,仍然需要每日注射胰岛素。
此后,世界上多家科研机构以及公司都对胰岛微囊化技术进行了研究并进行临床试验,虽然短期内糖尿病患者恢复了正常血糖并且摆脱了对胰岛素的依赖,但最后仍恢复到移植前的需要外源性补充胰岛素的状态。
“胰岛封装技术进展如火如荼,但目前国际上尚未制定封装胰岛的指南和专家共识,并且只有少数细胞封装技术进入临床试验阶段,无法进行大规模临床应用。”王轶表示,当微囊尺寸过大时,会导致微囊内胰岛缺乏氧气和营养而发生坏死;并且植入的微囊材料将会引起异物反应,导致宿主识别所引起的囊周纤维化过度生长,从而影响营养物质和氧气进入微囊、阻止胰岛素的释放和废物排放,这些都是此项技术的限制与不足之处。
目前,国内外关于胰岛乃至其他细胞如肝细胞包囊治疗疾病,已然成为组织器官移植再生领域研究的热点。
“我们未来对微囊材料的研究,主要集中探索新的封装技术,以提高水凝胶的生物相容性、稳健性和移植物的存活率。”王轶举例道,比如提高藻酸盐纯度,或改变海藻酸盐成分和几何形状;将胰岛与间充质干细胞共同封装能显著提高胰岛存活、减少免疫排异反应等。
此外,目前已知的肝门静脉和腹腔内并不是微囊化胰岛移植的理想部位,因此寻找免疫豁免区域作为微囊化胰岛移植部位,也可以有效解决免疫排异所致的胰岛功能丧失和纤维化的形成。
“随着封装技术的进步和发展,微囊化胰岛治疗糖尿病成功的临床试验数量有望增加。如能寻找到更适用的囊材和封装技术,则能进行大规模生产和封装胰岛,胰岛移植的成本将会大幅降低。这将为治愈糖尿病带来新的希望。”王轶说。
