mRNA编码CARs或TCRs,即CAR或TCR-mRNA工程T细胞
转自:药时空
工程嵌合抗原受体(CAR)或T细胞受体(TCR)有助于创造疾病特异性T细胞用于靶向治疗,许多临床前和临床试验中,这类过继T细胞疗法在治疗癌症方面显示出有希望的结果。TCRs和CARs的体外修饰对治疗方案的成功至关重要。到目前为止,一些CART产品或TCR基因工程的T细胞已经成功地进入临床研究,其中三种针对CD19抗原的CART产品(brexucabtageneautoleucel、tisagenlecleucel和axicabtageneciloleuce)已被FDA批准用于治疗B细胞白血病和淋巴瘤。递送体外转录(IVT)的CAR或TCRmRNA,用于瞬时重新编程T细胞以识别疾病相关抗原。重复输注CAR或TCRmRNA-纳米颗粒载体可以诱导足够的宿主T细胞表达肿瘤特异性CAR或病毒特异性TCR,从而导致疾病消退。
TCRs或CARs通过逆转录病毒或慢病毒基因转移进入自体或同种异体T细胞,然后进行体外扩增。然而,这种类型的病毒转导受体细胞具有基因突变的风险。所以,编码CAR或TCR的mRNA用于工程T细胞是有利的,其转染率高,对核基因没有毒性,而且成本很低(图a)。例如,在大多数研究中,电穿孔mRNACAR被广泛用作病毒转染法的一种新的替代方法。已发表的实验结果表明,这种方法能够使CARs在T细胞表面瞬时表达约一周,同时避免可能的CARs免疫反应。T细胞表面CARs的表达持续时间与编码CARs的mRNA在细胞内的活动持续时间相关。当所有转基因的CARmRNAs失活时,CARs将不再存在于T细胞表面。mRNA转染还允许递送额外的mRNA以编码其他免疫活性物质,以产生协同治疗效果。由于编码CARs或TCRs的mRNA在一段有限时间内(约1周)表达,这需要患者在每个治疗周期中重复注射CART产物,以维持CARs在体内的持续表达。通过改变mRNA的结构来提高稳定性和翻译效率,可以有效地延长CARs或TCRs的表达,减少重复给药的需要。早期的临床前研究表明,编码CARs或TCRs的mRNA转基因T细胞可以有效地对抗表达相应抗原的癌细胞。在一项早期I期试验(NCT01355965)中,评估了编码间皮素-1mRNA的CART细胞的治疗效果。这项试验首次报告了由CAR修饰的T细胞引起的临床过敏反应。在另一项转移性胰腺导管腺癌(NCT01897415)的临床试验中,6名患者接受了编码嵌合抗间皮素免疫受体SS1的mRNA转导的静脉T细胞。所有患者在治疗过程中均未出现明显不良反应,2名患者病情稳定,存活率显著提高。受到CART细胞抗癌的良好疗效的启发,针对不同肿瘤抗原的CART产品已被开发出来,并在针对各种实体瘤的I期和II期临床试验中进行了评估(NCT02719782、NCT03060356、NCT04981691和NCT05302037)。
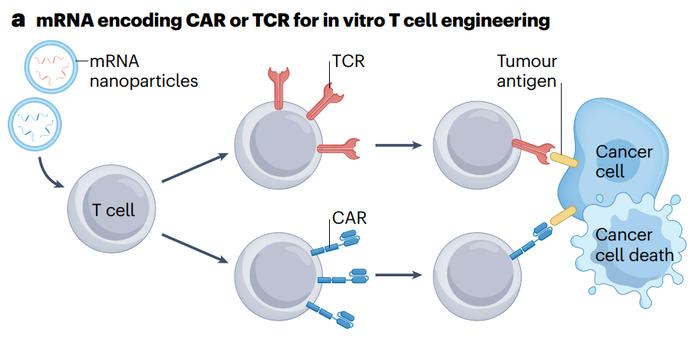
●图a体外转染编码CAR和TCR的mRNA进行T细胞修饰。首先从患者的血液中分离T细胞,在组织培养中扩增,然后用mRNA纳米颗粒进行转基因。然后,mRNA在细胞质中被翻译,产生TCR或CAR,并将其特异性地呈现给肿瘤细胞。然后它可以与肿瘤细胞结合并诱导肿瘤细胞死亡。
在难以治疗的血癌、AML和淋巴瘤的病例中,CART细胞疗法在治疗血液或淋巴癌方面显示出令人兴奋的结果。在针对CD19(NCT02277522和NCT02624258)的mRNACAR-T免疫治疗首次临床试验中,5名患者中有4名患者表现出良好的耐受性,没有明显的毒性,而第5名患者的不良反应在短时间内消失。尽管以CD123为靶点的mRNACART细胞在临床前异种移植小鼠模型中,AML导致白血病迅速清除,在抗CD123CART细胞的I期临床试验中,工程细胞没有抗肿瘤作用(NCT02623582)。
虽然基于mRNA的CART或TCRT细胞的体外工程具有在T细胞表面产生高水平编码的CAR或TCR的优势,但由此产生的工程化T细胞是个性化的细胞治疗产品,需要从患者身上提取T细胞,并且制造过程昂贵且耗时。为了克服这些挑战,编码CAR或TCR的T细胞靶向mRNA纳米颗粒可以静脉注射,导致体内产生CAR或TCR工程的T细胞(图b)。例如,一份报告探索了将T细胞靶向的mRNA纳米载体注射到小鼠体内,对循环中的T细胞进行基因重新编程,以瞬时表达CAR或TCR,用于治疗淋巴瘤、前列腺癌和乙肝病毒诱导的小鼠肝细胞癌。
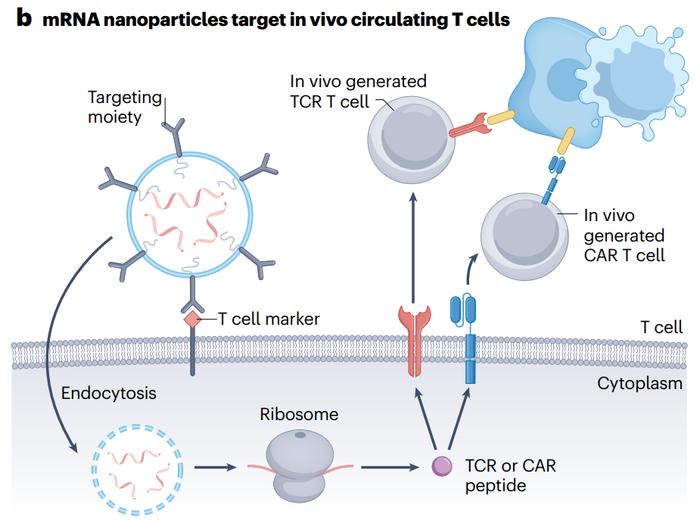
●图b以T细胞为靶点的mRNA-LNP(脂质纳米颗粒)可促进人T细胞体内产生CAR或TCR。患者接种T细胞靶向抗体(例如,anti-CD5抗体)功能化的mRNA-LNP通过内吞作用进入循环中的T细胞。在这里,编码CAR或TCR的mRNA在细胞质中被翻译,以驱动T细胞中CAR或TCR的表达。
参考文献:
Beck,J.D.etal.mRNAtherapeuticsincancerimmunotherapy.Mol.Cancer20,69(2021).
Parayath,N.N.,Stephan,S.B.,Koehne,A.L.,Nelson,P.S.&Stephan,M.T.Invitro-transcribedantigenreceptormRNAnanocarriersfortransientexpressionincirculatingTcellsinvivo.Nat.Commun.11,6080(2020).
Liu,C.,Shi,Q.,Huang,X.etal.mRNA-basedcancertherapeutics.NatRevCancer(2023).
WO2019213308A1
CN112055695A
