大湾区改良型新药注册扫描
2016年,原国家食品药品监督管理总局发布了《化学药品注册分类改革工作方案》,其中首次提到了改良型新药;2017年,中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,进一步强化了药品注册分类相关制度。随着2019年新修订的《药品管理法》和2020年新修订的《药品注册管理办法》正式实施,化学药品和生物制品的改良型新药注册分类正式明确。
与创新药相比,改良型新药具有研发耗资少、耗时短、风险低、高临床成功率、回报可观的优势,加上多项利好因素推动,越来越受到粤港澳大湾区药品企业的重视。
注册申报量激增
目前国内改良型新药仍处于起步阶段,随着国家药品注册制度改革与优化政策引导,粤港澳大湾区药企也越来越重视改良型新药的注册申请研发和生产工作。
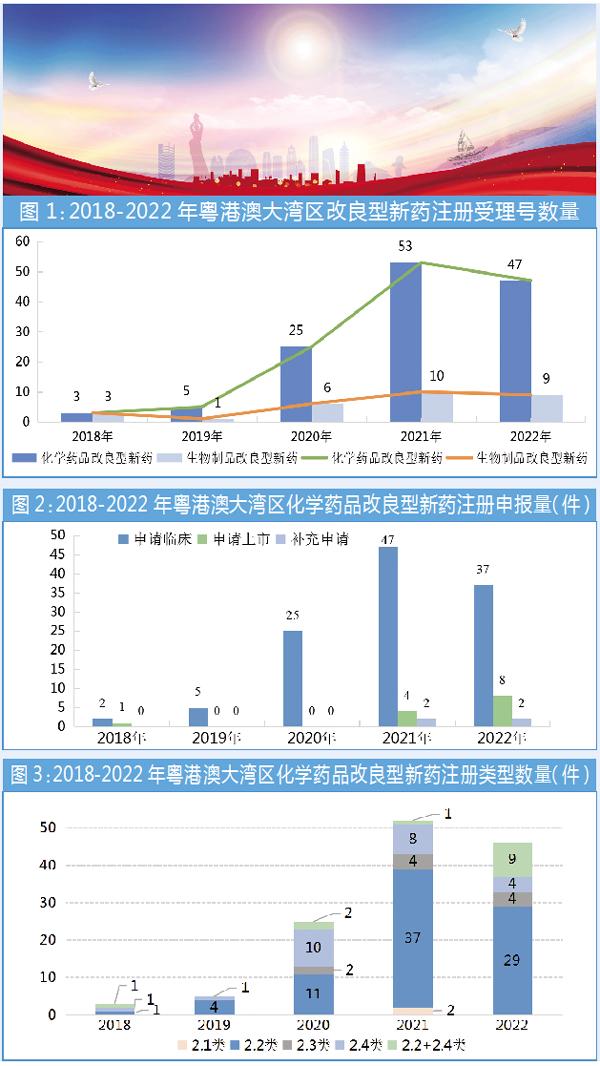
2018-2022年,国家药品监督管理局药品审评中心共受理大湾区化学药品改良型新药133件,其中IND申请116件,NDA申请13件,补充申请4件;生物制品改良型新药共29件,其中IND申请15件,NDA申请12件,补充申请2件。自2020年新版《药品注册管理办法》及配套文件出台、实施前后,改良型新药注册受理号数量呈现递增趋势,其中,2021年化药注册最为明显,是2020年的2倍左右(图1)。
随着相关政策和法规的实施和完善,粤港澳大湾区改良型新药的注册申报量快速提升,以申请临床为主。2022年,改良型新药上市申请开始提速,其研发周期短的特点逐渐显现。相比较而言,化学药品改良型新药的研发和注册申报较生物制品行业火热。
化药2.2类为首选
化学药品改良型新药的注册分类为2类产品,有4种类型:2.1类指含有用拆分或者合成等方法制得的已知活性成分的光学异构体,或者对已知活性成分成酯、成盐、改变已知盐类活性成分的酸根、碱基或金属元素等,且具有明显临床优势的药品;2.2类指含有已知活性成分的新剂型(包括新的给药系统)、新处方工艺、新给药途径,且具有明显临床优势的药品;2.3类指含有已知活性成分的新复方制剂,且具有明显临床优势;2.4类指含有已知活性成分的新适应症的药品。
从图2可知,从2020年开始,大湾区化药改良型新药临床试验申请数快速提升,近3年分别为25件、47件和37件;2022年因市场环境疫情等因素,临床申报有所减少。关于湾区改良型新药的上市申请注册申报,2021年有4件,2022年有8件。
截至目前,2.2类改剂型仍然是各大药企在改良型新药开发领域的首选,因其活性成分未改变,很多改进不需要做大规模临床试验,只需要通过BE试验证明其药动学一致即可,总体来看,研发成本相对较低。2018-2022年,2.2类申报占改良型新药整体申报的比例攀升,近3年申报数分别为11件、37件和29件。除了受研发单位青睐的2.2类改良型新药,2.4类新适应症改良型新药的开发亦方兴未艾,近3年申报数分别为10件、8件和4件。2.2+2.4类(即同时改剂型和新增适应症产品)近3年申报数分别为2件、1件和9件(图3)。
预告:关于大湾区生物制品改良型新药的注册申报等其他相关内容,详见下期报道。
