对mRNA疫苗免疫原性评估:mRNA疫苗在胃肠道肿瘤患者中诱导新抗原特异性T细胞免疫
转自:药时空
针对肿瘤的治疗性疫苗主要针对分化抗原、癌症-睾丸抗原和过度表达的抗原,到目前为止临床效果甚微。研究表明,识别新抗原的T细胞存在于大多数癌症中,并为个性化疫苗接种提供了一个特异性和高度免疫原性的靶点。这里开发了一种使用肿瘤浸润性淋巴细胞来识别患者肿瘤中表达的特定免疫原性突变的方法。在这里,验证的、定义的新抗原、预测的新表位和驱动基因的突变被串联到一个单一的mRNA结构中,用于接种转移性胃肠癌患者。该疫苗是安全的,并针对疫苗接种前未检测到的预测新表位激发突变特异性T细胞反应。此外,还能够分离和验证针对KRAS-G12D突变的T细胞受体(TCR)。未来这种疫苗与检查点抑制剂或过继T细胞疗法的潜在组合以评估常见上皮性癌患者的临床获益。
针对传染病的保护性疫苗接种已被证明是医学上最有效的健康措施之一;然而,针对持续性感染和癌症等既有疾病的治疗性疫苗接种已被证明更具挑战性。肿瘤疫苗的设计目标是能够诱导针对癌细胞而不是正常细胞的选择性免疫反应的抗原。针对非病毒肿瘤的治疗性疫苗主要针对分化抗原、肿瘤-睾丸抗原和/或过度表达的抗原,但临床影响很小。
近年来,广泛研究了新抗原作为免疫治疗靶点的重要性。现在很清楚,新抗原特异性T细胞存在于大多数癌症中。来自体细胞突变的新抗原为疫苗接种提供了一个特异性和高度免疫原性的靶点。
最近几项研究报告了黑色素瘤患者接种新抗原疫苗的情况。虽然在这些试验中评估的候选新抗原的集合可以引发T细胞反应,但功能验证,包括分析T细胞识别自然处理和呈递的抗原的能力,仅对有限数量的反应进行。尽管这些试验证明了这种疫苗的可行性、安全性和免疫原性,但缺乏关于其临床疗效的明确证据。一个能够编码多种肿瘤相关抗原的免疫接种平台,可以在个性化的环境下生产,对于开发用于常见上皮性癌患者的新抗原疫苗至关重要。此外,选择相关和免疫原性的疫苗新抗原仍然是一个主要障碍。在这里,开发了一条管线,用于选择由自体癌症表达并由患者的肿瘤浸润性淋巴细胞(TIL)识别的特定疫苗新抗原,并对其免疫原性进行功能测试。这种名为mRNA-4650的疫苗由编码多达20种不同抗原的mRNA骨架组成。除了确定的抗原,疫苗主干还包含通过自体肿瘤外显子组测序鉴定的TP53、KRAS或PIK3CA中的任何突变,以及多达15个预测与患者MHC等位基因结合的HLAI类候选新抗原。临床试验NCI-18-C-0072为患者接种疫苗,并评估个性化mRNA疫苗的安全性、免疫原性和临床疗效。
01
患者和方法
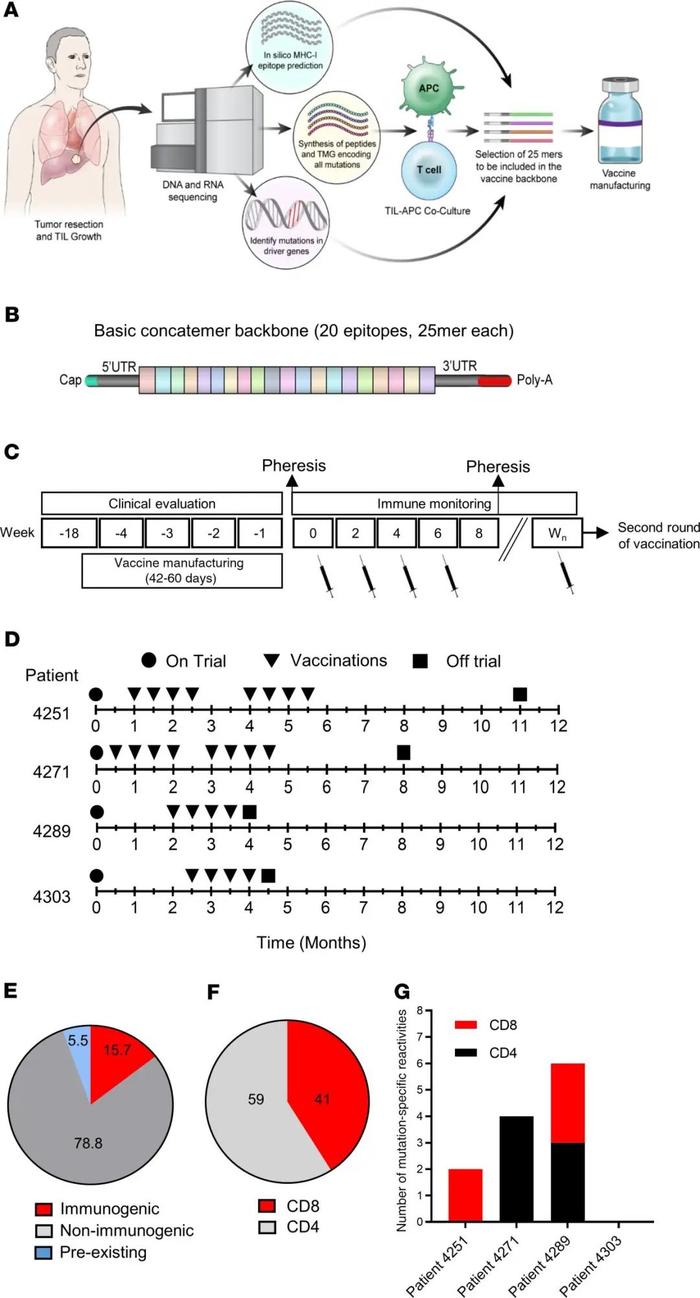
在2018年3月29日至2019年11月13日期间,4名转移性胃肠道(GI)癌症患者接受了编码自体癌症表达的新抗原的mRNA疫苗治疗(见图1)。表1列出了每个患者的基线特征。所有患者都经过诊断,并接受了多种药物的大量预治疗。4例患者中有3例(4251、4271和4303)以前接受过TILs治疗。2名患者(4251和4271)以前接受过抗PD-1药物治疗。患者接受了编码由自体癌症表达的明确新抗原、表达的驱动基因的突变和HLAI预测的免疫原性突变的组合的mRNA疫苗(图2A)。为了鉴定确定的抗原,采集了转移的肿瘤,并培养了TIL以供将来测试。对每个切除的肿瘤和配对PBMC样本进行测序,以确定肿瘤特异性突变。如前所述,通过使用覆盖所有突变表位的长肽和串联微型基因(TMG)的高通量免疫筛选,鉴定由自体TIL识别的新抗原。除了确定的抗原,还包括了TP53、KRAS或PIK3CA驱动基因的任何突变,以及计算机预测的HLA-I潜在新抗原中的多达15个突变。由25个aa组成的序列,两侧各有12个正常aa,以电子方式提交给ModernaTherapeutics公司,用于生产基于TMG的疫苗(图2B)。所有疫苗的周转时间在42至60天之间。一旦准备就绪疫苗就被运送,患者在NIH临床中心接种了疫苗。患者每隔2周肌肉注射疫苗4次(图2C和D)。患者4251和4271接种0.13mgmRNA疫苗,患者4289和4303接种0.39mg。在所有4名患者中,观察到1级和2级毒性迅速消退,没有3级或严重不良事件(SAE)。如图2E所示,共有15.7%的潜在新抗原诱导了特异性T细胞免疫;其中59%是CD4表位,41%是CD8表位(图2F)。疫苗诱导的突变数量对患者4251是2,对患者4271是4,对患者4289是6(图2G)。
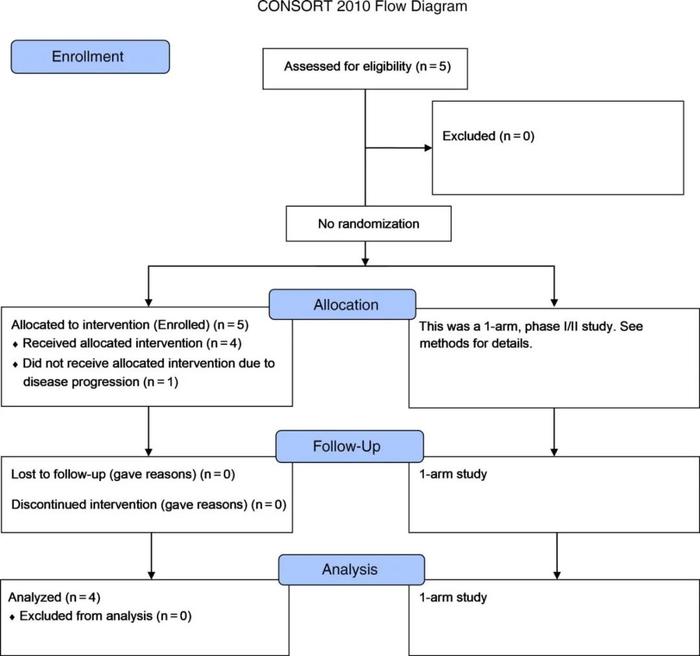
●表1病人特征
02
4251患者mRNA-4650的免疫原性
第一个参加试验的患者是4251,45岁的男性,被诊断为胃腺癌。在对患者4251进行了TIL筛查,以确定是否存在针对体细胞突变的TIL。在初始筛选中发现了4个已确定的新抗原:HNRNPU-F580I、RNF213-P4766H、FMOD-S332N和TRAFD1-R11L。患者4251的肿瘤测序数据没有显示出驱动基因的任何突变。这名患者之前在NIH临床中心接受了针对体细胞突变的TIL治疗,后来又接受了pembrolizumab的治疗。根据这些测序数据选择了另外15个预测的HLA-I表位,并生产了一种由19个序列组成的疫苗(SupplementaryTable2)。患者接种了0.13mg的个性化mRNA-4650疫苗,并评估了T细胞对疫苗多肽的反应。为了评价mRNA-4650的免疫原性,采集接种前后的单采产物,并用PBMC产生单核细胞来源的DC。然后,进行体外刺激(IVS),用覆盖所有疫苗表位的25mer肽脉冲或用与疫苗类似的编码序列的TMG构建体转染自体DC刺激从接种前后的PBMC样本中获得的T细胞。对从疫苗前阶段获得的T细胞的反应性分析表明,T细胞识别RNF213,这是先前注射的TIL识别的新抗原之一,可能代表治疗后持续存在于外周血中的T细胞的反应(图3A)。在接种4次疫苗后,观察了T细胞对COL6A3(CD8)和LOC1000288014(CD4)两个突变多肽的反应性。患者在接种前4次疫苗后病情稳定,因此接受了第二轮疫苗接种。在另外接种3次疫苗后,观察了对突变型OR10H1(CD8)、ITIH(CD4)和NCAPD3(CD4)候选新抗原的反应性。为了评估疫苗特异性T细胞对WT序列的反应性,根据CD4和CD8反应性T细胞在抗原激活后上调4-1BB表达的能力,对它们进行了重新刺激、分选和扩增。观察到OR10H1和COL6A3新抗原的突变特异性反应,而LOC1000288014细胞对突变多肽和WT多肽的滴度剂量表现出相同的反应(图3B)。为了进一步分析突变特异性T细胞,对COL6A3特异性细胞进行了重新刺激和测序,以进行单细胞T细胞受体(TCR)测序,从而鉴定出主要的TCRα和β链序列(图4A)。用编码COL6A3TCR的逆转录病毒载体转导患者4251的PBMC的反应性分析表明,TCR介导了对突变体的识别,而不是WT肽的识别(图4B)。进一步分析表明,COL6A3和OR10H1反应性T细胞分别受HLA-B35:01和HLA-A03:01的限制(图4C)。
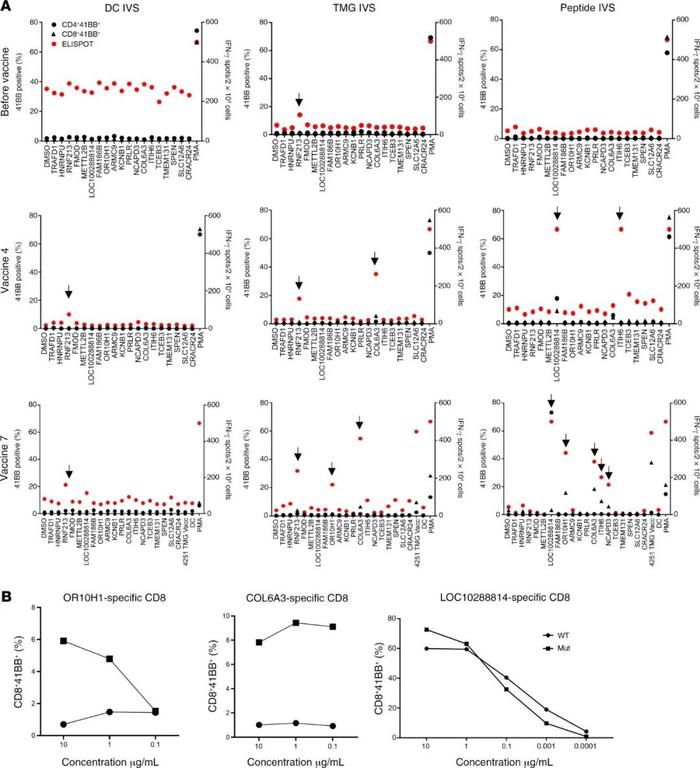
●图3患者4251的免疫监测。(A)从PBMCs中阴性选择T细胞,并使用TMG转染或多肽负载的DC进行IVS。单独的DC作为阴性对照。然后用负载单肽的DC重新刺激IVS培养,用流式细胞仪检测4-1BB的表达,或用ELISPOT法检测IFN-γ的分泌。提供了疫苗接种前、接种4次疫苗后和接种7次疫苗后多肽或TMG重新刺激后的数据。阳性反应定义为IFN-γ和4-1BB或OX40的表达水平高于DMSO对照水平的3倍。所有积极的回答都用黑色箭头表示。(B)与来自A的DMSO样本相比,阳性T细胞培养至少增加3倍,与负载WT或突变长肽(Mut)的自体DC共培养18h。通过4-1BB上调的流式细胞术证据测试细胞的抗原识别能力。
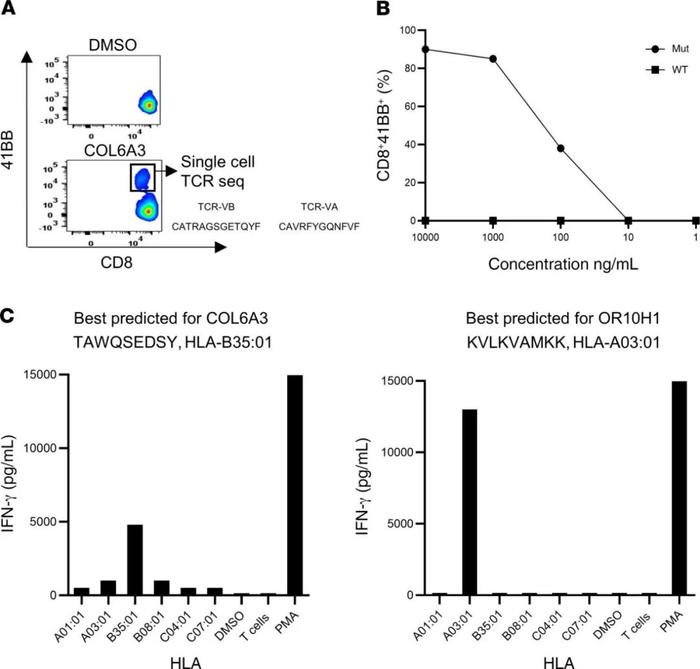
●图4患者4251的免疫监测。(A)COL6A3细胞再刺激,按4-1BB上调分成96孔板进行单细胞TCR测序。(B)TCR转导的PBL与用连续稀释的COL6A3突变(Mut)或WT多肽脉冲的DC共培养。(C)COS-7细胞用患者的每个HLA-I类转染,加载肽,并与COL6A3和OR10H1特异性细胞共培养。通过上调4-1BB表面标志物来确定反应性。
03
4271患者mRNA-4650的免疫原性
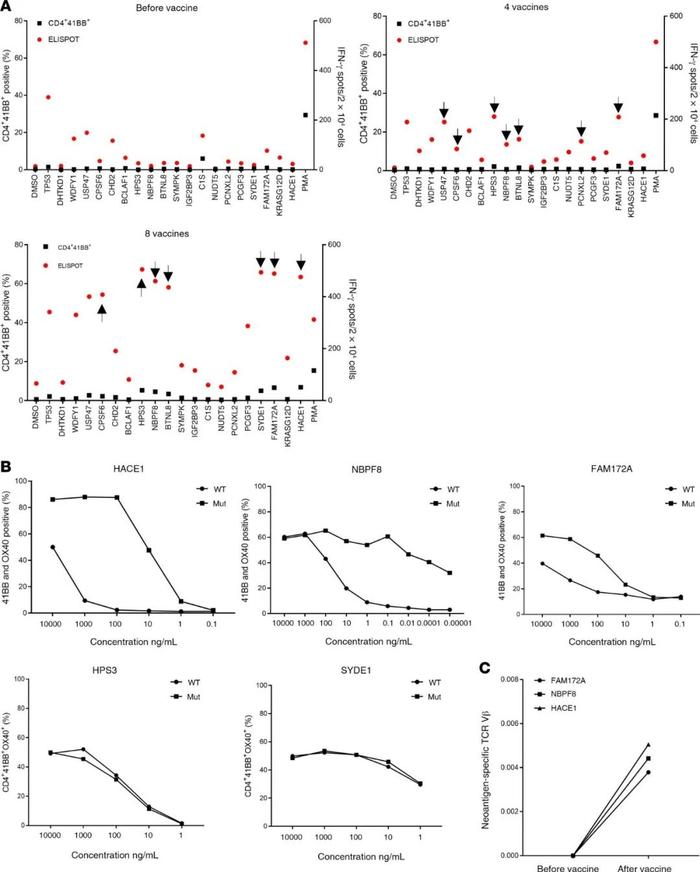
虽然主要观察到4251患者接种疫苗后的CD8反应,但其他患者的疫苗接种导致了CD4+T细胞的刺激。患者4271是一位37岁的男性转移性结肠癌患者,他接受了新抗原反应性的TIL治疗,随后又接受了pembrolizumab(图2D)的治疗,结果显示对5种不同的新抗原具有反应性:CPSF6-G178E(CD8)、WDFY1-E44K(CD8)、DHTKD1-V643I(CD8)、CHD2-K1351R(CD4)和USP47-F1156L(CD4)。5个确定的新抗原、2个驱动基因突变(TP53-C96F和KRAS-G12D)、13个预测的新抗原包括在疫苗主干中(SupplementaryTable3),患者接种了0.13mg的个性化mRNA-4650疫苗。对预接种T细胞的分析显示,T细胞对两种已定义的新抗原(WDFY1和USP47)具有反应性,这可能代表在TIL治疗后持续存在的T细胞的反应性,以及对两种新抗原TP53和C1S的低水平CD4+T细胞反应(图5A)。虽然在最初的筛查中发现了这些T细胞群,但无法对这些T细胞群进行分选和扩增以评估它们的WT识别和肽滴定,但在4次疫苗后检测到T细胞对另外6个候选者CHD2、HPS3、NBPF8、BTNL8、PCNXL2和FAM172A的反应性(图5A)。患者在前4次接种疫苗后病情稳定,并接受了第二轮疫苗接种,在总共8次疫苗接种后,发现了另外2种针对HACE1和SYDE1的反应(图5A)。基于4-1BB上调的新抗原特异性群体(图5A)的重新刺激和分选导致了对5种候选新抗原的反应的T细胞培养的扩增,其中3种(HACE1、NBPF8和FAM172A)似乎特异性地识别突变而不是WT肽,其中2种(HPS3和SYDE1)不区分突变和相应的WT肽(图5B)。为了进一步验证疫苗接种后产生的T细胞的反应性,用多肽脉冲的DC重新刺激了HACE1、NBPF8和FAM172A特异性的T细胞。然后,对抗原刺激后上调4-1BB表达的细胞进行分选,并对分选的T细胞进行TCRVB测序。TCRVB分析显示,只有在接种疫苗后才能检测到新抗原特异性克隆(图5C)。虽然在最初的筛查中没有发现对突变的KRAS的反应性,但在4次疫苗接种后,从患者4271分离的T细胞被用KRAS-G12D肽或包含所有KRAS突变的TMG和全长KRAS-G12D构建体的TMG进行为期10天的IVS。将IVS培养的DC与负载WT的DC和突变的KRAS多肽或转染KRASTMG或全长KRAS-G12D的DC进行比较。在长肽致敏的T细胞体外培养中观察到针对KRAS-G12D的突变特异性T细胞反应性,而对WT肽没有观察到反应(图6A),共培养的流式细胞仪分析显示突变特异性T细胞为CD4+(图6B)。用KRAS-G12D肽重新刺激培养物并对4-1BB+细胞进行单细胞TCR测序(图6C),鉴定出4条不同的TCRα和TCRβ链(图6D),它们被合成、克隆并逆转录病毒转导到自体外周血淋巴细胞(PBL)。TCR转导的PBL与负载不同浓度突变和WTKRAS多肽的DC共培养表明,这4个TCR特异性识别KRAS-G12D新表位,而不识别WT序列(图6D)。
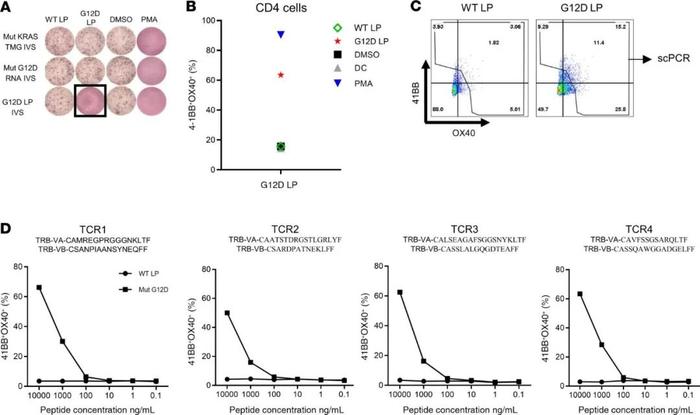
●图6KRAS-G12D特异性TCR的检测、生成和分析。(A)从PBMCs中阴性选择T细胞,并使用全长KRASRNA、KRASTMGs或负载多肽的DC进行IVS。用自体DC负载10μg/mLWT或G12D长肽(LP)、DMSO或PMA(阳性对照)进行再刺激。用ELISPOT法检测IFN-γ的分泌(A)和流式细胞仪检测4-1BB/OX40的上调(B)。(C)对阳性细胞进行再刺激,按4-1BB上调分选成96孔板,进行单细胞TCR测序。(D)单细胞TCR测序发现TCRVα和TCRVβ序列。将TCRVβ和TCRVα克隆到逆转录病毒载体中,转导到自体PBL中,并检测其与不同浓度的KRAS-G12D或WT长肽负载的自体DC的反应性。
04
4289患者mRNA-4650的免疫原性
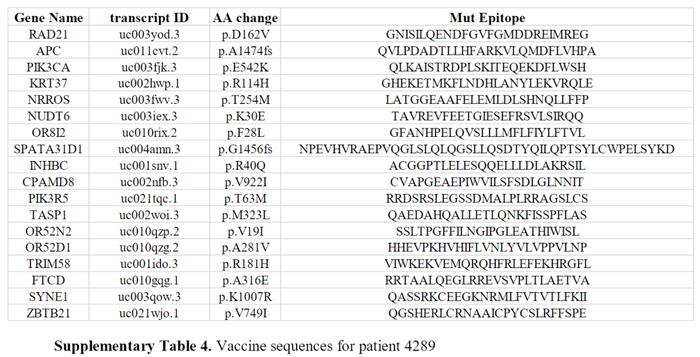
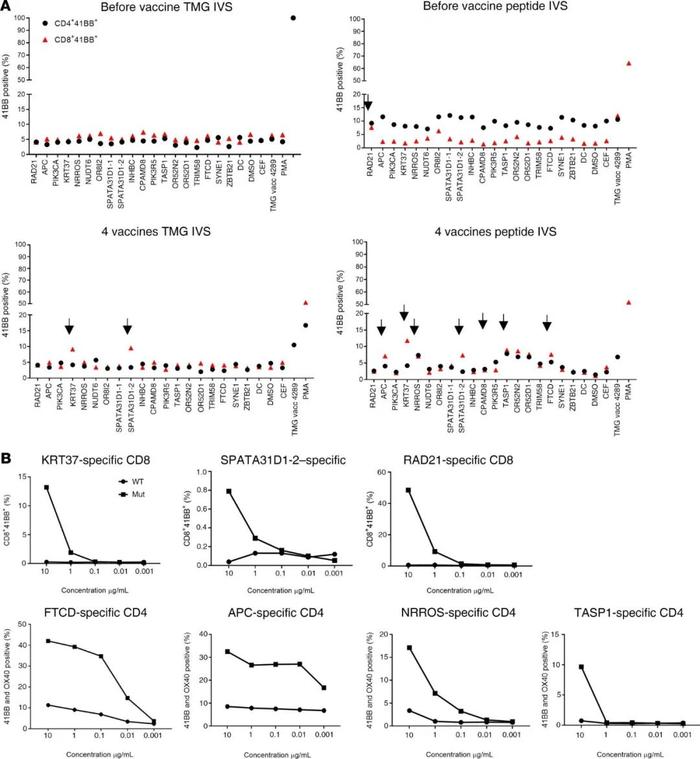
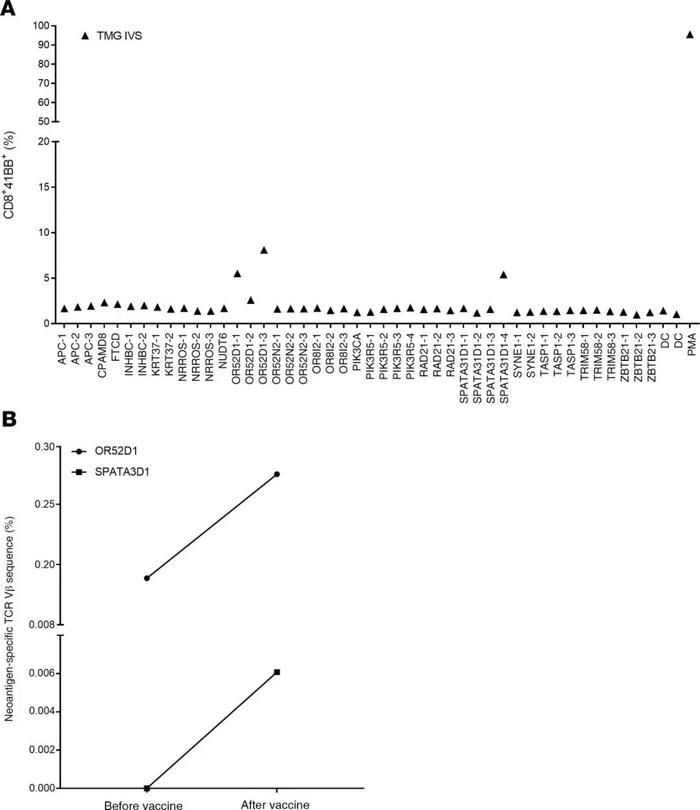
考虑到前两名患者的良好安全性,mRNA-4650疫苗剂量被上调至0.39mg。第一个接种该剂量疫苗的患者是4289,一名42岁的转移性直肠癌女性,接受了对新抗原的TIL反应筛查,但她是试验中唯一在接种前未接受TIL治疗的患者(表1)。TIL筛查显示CD4+T细胞对RAD21-D162V具有反应性,与驱动基因(APC-A1474fs和PIK3CA-D162V)的2个突变和15个预测的新抗原一起被包括在疫苗中(SupplementaryTable4)。在对疫苗免疫原性的评估中,在接种疫苗前在外周血中发现的唯一新的表位反应性似乎是针对RAD21的,但与在患者的TIL中观察到的反应性相反,这种反应性似乎仅限于CD8而不是CD4(图7A)。在4次疫苗后,总共确定了9个由多肽或TMG刺激的T细胞识别的潜在新抗原(图7A)。对根据多肽刺激上调4-1BB表达进行分选并经OKT3刺激扩增的培养物检测,提供了针对2个CD8表位(KRT37和SPATA31D1-2)和3个CD4表位(FTCD、APC和NRROS)的突变特异性反应的证据(图7B)。另一种CD4+T细胞培养显示出对TASP1的反应性,但仅在较高的多肽浓度下。还对TMGIVS培养物与预测的HLA-I肽库进行了筛选,发现了另一种针对OR52D1的CD8反应(图8A)。与患者4271一样,从每个新抗原特异性T细胞培养中重新刺激和分选4-1BB+细胞,并对这些样本和从患者收集的PBMC进行TCRVB分析。只在PBMC样本中发现2个新抗原特异性克隆(OR52D1和SPATA3D1)在接种后出现的频率较高(图8B)。
05
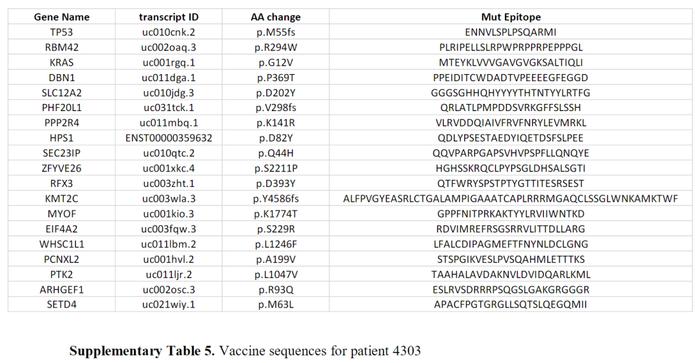
4303患者mRNA-4650的免疫原性
在试验中,另一名直肠癌患者(患者4303,SupplementaryTable5)总共接种了4次疫苗,剂量为0.39mg。患者接种了由1个确定的新抗原(RBM42)、外显子组和RNA-Seq检测到的驱动基因(TP53和KRAS)的2个突变和16个预测的潜在新抗原组成的mRNA疫苗。根据免疫监测,没有观察到任何与疫苗相关的刺激,无论是先前存在的还是新的反应性。
讨论与总结
在这项工作中,测试了一种编码特定新抗原、驱动基因突变和HLA-I预测表位的新型mRNA疫苗在转移性胃肠癌患者中的安全性和免疫原性。本试验未达到最大耐受量(MTD)。试验的最大剂量为0.39mg,没有观察到严重的副作用。虽然没有观察到任何临床反应,但在4名患者中的3名患者中,可以检测到疫苗诱导的CD8和CD4+新抗原特异性T细胞。临床试验现已结束,这项试验最初设计为I/II阶段试验。I期部分的基本设计应包括3个剂量(0.04mg、0.13mg和0.39mg)的每剂3名患者。因为Moderna进行了一项平行的临床试验,并且已经排除了第一剂(0.04mg),所以这里跳过了0.04mg的剂量,从0.13mg的剂量开始。当前2名患者接受0.13mg剂量的治疗时,Moderna清除了剂量,继续对最后2名患者使用0.39mg剂量。由于没有观察到临床反应,而且Moderna进行联合使用抗PD-1药物的临床试验,决定不继续进行临床试验的第二阶段。加入经TIL培养功能验证的已确定新抗原的主要目的是试图用临床相关抗原接种患者,这在以前报道的疫苗试验中是没有做到的。疫苗中包括的特定新抗原的特异性T细胞的频率在任何患者中都没有观察到增加。虽然在一些患者(患者4251和4271)中,观察到对一些已定义的新抗原的预先存在的免疫,可能是由于他们的TIL治疗,但疫苗没有进一步刺激已定义的新抗原。在患者4251和4271中,额外的疫苗接种激发了新的T细胞反应,可能是因为疫苗进一步刺激了低频T细胞。所有的分析都是在PBMC中进行的,因为在接种疫苗后没有可用的肿瘤组织来分析肿瘤内的T细胞库。大多数记忆T细胞驻留在组织中,因此PBMC分析可能具有误导性,因为它可能不能充分代表新的抗原反应性T细胞群体。此外,早期治疗后持续存在的TIL可能是终末分化的,对疫苗的反应较差。有趣的是,尽管试图对患者4251(RNF213)和4271(WDFY1和USP47)的样本中先前存在的反应性进行分选和扩增,但没有一种培养物生长,可能是因为它们的分化状态耗尽。此外,作为TIL方案的一部分,以前接受TIL治疗的患者接受了环磷酰胺和氟达拉滨的条件淋巴净化,这可以重置内源性T细胞库,推迟新的CD4+和CD8+T细胞的出现。总而言之,这些因素可以潜在地解释疫苗定义的新抗原缺乏刺激的原因。在1例患者(4303)中,在接种疫苗后没有观察到T细胞反应。这可能是由于疫苗主干或其他临床或物理方面缺乏抗原表位所致。
有趣的是,尽管使用了一种预测算法来预测HLA-I限制性多肽,但疫苗主要激发了CD4+,而不是其他人之前报道的CD8+T细胞特异性反应。虽然人们普遍认为内源性多肽主要是由HLA-I限制性表位产生的,但疫苗似乎更好地诱导了CD4+T细胞反应。这种现象可能是由于疫苗mRNA的高表达导致多肽的产生,这些多肽可以装载在组织驻留的抗原提呈细胞(APC)上,并刺激CD4+T细胞。也有可能CD4+T细胞的克隆异质性比CD8+T细胞的克隆异质性更广,这可能有助于更广泛的抗原覆盖率。与其他肿瘤治疗性疫苗一样,可以增加患者PBMCs中癌症特异性T细胞的频率,但没有观察到临床益处。参与试验的5名患者中有4名接受了至少1轮疫苗治疗(见图1)。尽管筛查患者TIL的新抗原反应性是可行的,但这是一个昂贵且耗时的过程,将限制这种疫苗接种方法的适用性。此外,已识别的肿瘤新抗原的使用似乎并未对疫苗的临床效果做出贡献。因此,未来的试验可能会使用更快、更便宜的方法来选择潜在的新抗原。不幸的是,这里不能进行任何功能或表型研究,主要是因为只有在IVS后才检测到疫苗诱导的新抗原反应。在这种情况下,细胞已经在存在细胞因子的情况下受到刺激,因此失去了最初的表型。
疫苗作为单一制剂在根除各种抗原上已建立的肿瘤方面历来并不有效。然而,最近发表了新抗原疫苗在胶质母细胞瘤患者中具有免疫原性的证据,包括观察到疫苗诱导的T细胞在肿瘤内的渗透。尽管在目前的试点试验中没有肿瘤缩小,但这里提供的免疫原性数据打开了使用疫苗和其他免疫调节剂(如检查点抑制剂)的组合治疗常见上皮性癌症患者的可能性。这种mRNA新抗原疫苗也可能通过在体内重新刺激T细胞来改善新抗原特异性细胞的过继T细胞治疗。
参考文献:
KeskinDBetal.NeoantigenvaccinegeneratesintratumoralTcellresponsesinphaseIbglioblastomatrial.Nature.2019.
LekoVetal.Identificationofneoantigen-reactivetumor-infiltratinglymphocytesinprimarybladdercancer.JImmunol.2019.
GalCafri,etal.mRNAvaccine–inducedneoantigen-specificTcellimmunityinpatientswithgastrointestinalcancer.JClinInvest.2020.
ParkhurstMRetal.Uniqueneoantigensarisefromsomaticmutationsinpatientswithgastrointestinalcancers.CancerDiscov.2019.
StevanovićSetal.AphaseIIstudyoftumorinfiltratinglymphocytetherapyforhumanpapillomavirus-associatedepithelialcancers.ClinCancerRes.2019.
