重磅!FDA 正式批准 Paxlovid 用于治疗轻度至中度的潜在高危 COVID-19 成人感染者
转自:药时空
2023年5月25日,美国食品和药品监督管理局(FDA)正式批准了辉瑞(Pfizer)的口服抗新冠病毒药物Paxlovid用于治疗成人患者的轻至中度COVID-19感染者。这些患者处于严重COVID-19进展的高风险之中,如果放任进展他们很有可能会入院乃至死亡。
Paxlovid是FDA批准的第四种用于治疗成人COVID-19的药物,也是唯一一款口服抗病毒药,由Nirmatrelvir和Ritonavir两种药物组合而成的口服制剂。
根据紧急使用授权(EUA)生产的、由美国卫生与公共服务部分配的Paxlovid,将继续提供给成年患者,并确保对符合条件的12-18岁的儿童进行治疗。不过,儿童并未被纳入此次的批准范围。此外,Paxlovid未被批准或授权作为预防COVID-19的前暴露或后暴露的保护药剂。
FDA 中心主任PatriziaCavazzoni博士表示:尽管疫情对我们所有人来说都是挑战,但我们已经取得了很大进展,减轻了COVID-19对我们生活的影响。此次的批准表明,Paxlovid已达到FDA对药物安全性和有效性的严格标准,将是高风险人群的重要治疗选择。FDA致力于与研发机构合作,促进COVID-19相关的新的预防和治疗方案的开发。
根据《美国联邦食品、药品和化妆品法》,批准一种新药需要大量的证据证明其有效性和安全性。在考虑批准一种新药时,FDA会基于严格的科学标准进行受益风险评估,以确保药物的好处大于其预期人群的实际风险。
Paxlovid的有效性主要得到了EPIC-HR临床试验的最终结果支持。
EPIC-HR是一项随机、双盲、安慰剂对照的临床试验,旨在研究Paxlovid对非住院症状明显的成年患者(18岁及以上)的治疗作用。入组受试群体已经通过实验室确认了SARS-CoV-2病毒的感染。患者是具有特定严重疾病进展风险因素的18岁及以上成年人,或者60岁及以上无论是否存在慢性病史。所有患者都没有接种COVID-19疫苗,也没有在先前感染过COVID-19。
EPIC-HR试验结果表明,感染者在感染五天之内接受Paxlovid治疗,能够将COVID-19导致的住院或死亡相关的比例降低86%!事实上,在感染之后的28天跟踪观察期间内,Paxlovid可将持续减少86%。在这项研究中,共有977名高风险感染者接受了Paxlovid治疗,同时有989名感染者接受了安慰剂。
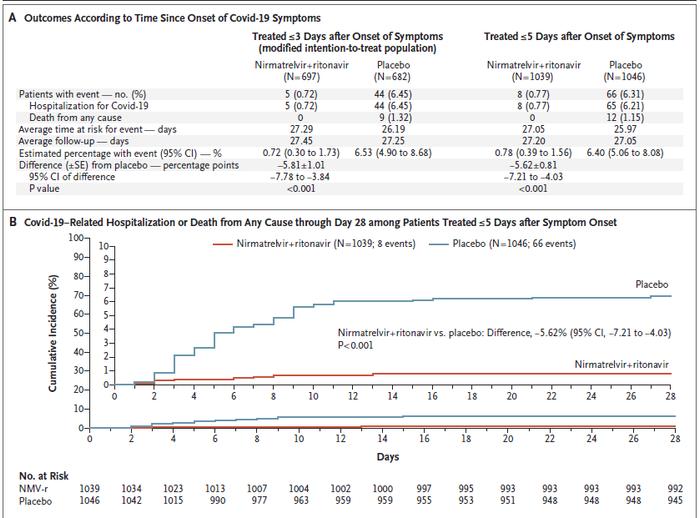
在Paxlovid治疗组中,仅有 0.9%的感染者因COVID-19而导致住院或死亡。相比之下,安慰剂组中有6.5%的感染者在28天的随访期间加重到住院或死亡的程度。
Paxlovid的效果在已对COVID-19形成免疫力的患者身上也得到了验证。在EPIC-HR试验中的抗体阳性患者中,接受Paxlovid治疗的患者在28天内因任何原因而导致COVID-19相关的住院或死亡的风险为0.2%,而接受安慰剂治疗的患者的风险为1.7%。EPIC-SR是一项将接种了至少一种COVID-19风险因素的成年患者纳入研究的临床试验。虽然未具统计学意义,但在接种了疫苗并具有至少一种风险因素的接种者中,COVID-19相关的住院或死亡的风险也有所降低。
EPIC-HR和EPIC-SR这两项随机对照试验,还提供了有关COVID-19反弹的信息。来自这两项试验的数据表明,SARS-CoV-2(RNA或病毒)脱落或COVID-19症状在患者中只有极小部分出现反弹,而且在接受Paxlovid治疗和接受安慰剂治疗的患者中都有发生。根据目前研究结构提供给FDA的数据,目前还没有明确的证据表明Paxlovid治疗与COVID-19反弹之间存在关联。
