刚刚!合源生物CAR-T产品「纳基奥仑赛」在中国获批,治疗白血病!
转自:医药观澜
今日(11月8日),中国国家药监局(NMPA)官网公示,合源生物递交的CAR-T产品纳基奥仑赛注射液(曾用名:赫基仑赛)的上市申请已获得批准,用于治疗成人复发或难治性B细胞急性淋巴细胞白血病(r/rB-ALL)。值得一提的是,这也是首款在中国获批上市的治疗白血病的CAR-T产品。

白血病是常见的血液肿瘤之一,急性淋巴细胞白血病(ALL)约占所有白血病的15%,其中B淋巴细胞型-ALL(B-ALL)约占ALL的75%。成人B-ALL患者较儿童B-ALL患者整体生存更差。成人B-ALL初治后复发率高,约60%的患者最终会进展到r/rB-ALL。成人r/rB-ALL患者预后极差,严重危及生命,临床缺乏有效治疗手段。
纳基奥仑赛注射液(CNCT19细胞注射液,InaticabtageneAutoleucel)是一款靶向CD19的CAR-T细胞治疗产品,拥有创新的CD19scFv(HI19a)结构。该药已在中国获批多项临床试验,针对的适应症包括:用于治疗成人复发或难治性ALL、治疗复发或难治性侵袭性B细胞非霍奇金淋巴瘤和治疗儿童和青少年复发或难治B细胞型ALL。其中,该药针对复发或难治性ALL的申请还被NMPA纳入突破性治疗品种。
2022年12月,中国国家药品监督管理局药品审评中心(CDE)正式受理了纳基奥仑赛注射液治疗成人复发或难治性B细胞型急性淋巴细胞白血病的新药上市申请,并将其纳入优先审评,这也是该药本次获批的适应症。
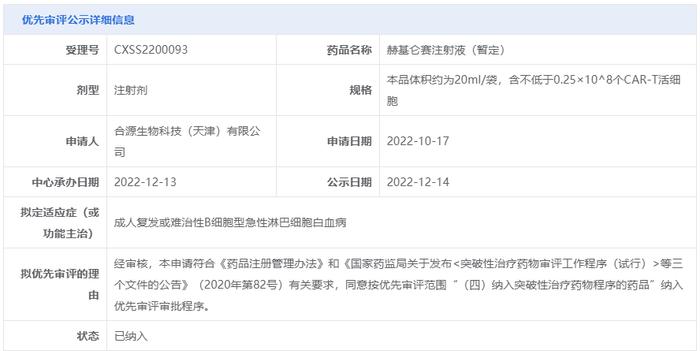
CDE官网
纳基奥仑赛的上市申请是基于一项用于治疗成人复发或难治性B细胞型急性淋巴细胞白血病的单臂、开放、多中心关键性临床研究。该研究由中国医学科学院血液病医院(中国医学科学院血液学研究所)王建祥教授担任主要研究者,在中国10家临床中心开展。主要研究终点为经独立评审委员会(IRC)评估的纳基奥仑赛回输后3个月时的总体缓解率(ORR),包括完全缓解(CR)和血细胞不完全恢复的完全缓解(CRi)。次要研究终点包括3个月内总体缓解率(ORR)、微小残留病阴性率(MRD-)、缓解持续时间(DOR)、无复发生存期(RFS)和总生存期(OS)。

在2022年12月进行的第64届美国血液学年会(ASH)上,研究人员以大会口头报告的形式发布了这一关键性临床研究数据。截至2022年9月27日,39例成人r/rB-ALL患者接受了纳基奥仑赛注射液回输。具体试验数据如下。
患者显示了持久的高缓解率:总体缓解率(ORR)达82.1%,中位随访9.3个月时,中位缓解持续时间(DOR)尚未达到;在3个月时仍缓解的患者中,1年时预计有80%患者在持续缓解中;无论是否后续接受造血干细胞移植,均能表现出持续缓解和长期生存获益。
显著降低的CAR-T治疗相关毒性严重性:3级及以上细胞因子风暴(CRS)发生率为10.3%;3级及以上免疫效应细胞相关神经毒性综合征(ICANS)发生率为7.7%,无非预期靶向CD19CAR-T治疗导致的不良事件发生。
值得一提的是,今年3月,美国FDA也已批准纳基奥仑赛注射液的IND申请,拟开发用于治疗成人复发或难治性B细胞型急性淋巴细胞白血病(B-ALL)。希望纳基奥仑赛注射液的其它临床研究也顺利进行,早日惠及更多患者。
参考资料:
[1]国家药监局附条件批准纳基奥仑赛注射液上市 .RetrievedNov8,2023,from https://www.nmpa.gov.cn/zhuanti/cxylqx/cxypxx/20231108092415187.html
[2]白血病持久缓解伴长期生存获益:合源生物赫基仑赛注射液关键性临床研究数据在2022ASH年会全球发布.RetrievedDec12,2022.Fromhttps://mp.weixin.qq.com/s/cnaiwst51316sJN4pmwXgg[3]合源生物赫基仑赛注射液新药上市申请获国家药品监督管理局正式受理.RetrievedDec14,2022.From https://mp.weixin.qq.com/s/1vBGtbZrvffxJkEe3pqK9A
[4]合源生物CAR-T新药赫基仑赛注射液IND申请获美国FDA许可.RetrievedMar 14,2023.From https://mp.weixin.qq.com/s/IZ9WyevsyrHy80dz8SItAQ
