Cell封面:浙大团队揭示无膜细胞器异常是导致周围神经病的关键机制

腓骨肌萎缩症(Charcot-Marie-Toothneuropathies,CMT)是一组临床上常见的周围神经遗传病,发病率约为1/2500。根据致病基因的不同,CMT可分为几十种不同的亚型。就CMT患者总数而言,在全国范围内是一个非常庞大的数字,然而,具体到某些亚型的患者数量却非常稀少,因此,CMT被收录到国家《第一批罕见病名录》。长久以来,令人困惑的是,这几十种CMT致病蛋白在细胞中的定位和生理功能各异,似乎没有任何明显的共性,然而,这些突变蛋白却会导致CMT患者表现出非常相似的临床症状。
这个被称之为“疾病遗传异质性”的谜团长期以来一直困扰着广大神经科学家和临床工作者。有没有可能不同的致病蛋白最后通过一个“殊途同归”的共同机制引发相似症状?

近日,浙江大学医学院脑科学与脑医学学院白戈课题组联合中国科学院分子细胞科学卓越创新中心李劲松院士课题组在《Cell》杂志以封面文章在线发表了题为“DiverseCMT2NeuropathiesareLinkedtoAberrantG3BPInteractionsinStressGranules”的研究论文。
该工作发现,虽然在正常生理状态下不同CMT致病蛋白在细胞中的定位各异,但在应激状态下这些CMT致病蛋白会表现出相同的细胞定位,进入应激颗粒中(细胞内一种介导应激反应的无膜细胞器)并与其核心蛋白G3BP发生异常互作,引起应激颗粒异常,使得周围神经应对环境不良刺激的能力下降,从而导致周围神经病的发生。该工作揭示了应激颗粒异常是介导不同亚型CMT的共同致病机制,为针对多亚型CMT的广谱治疗药物的开发提供了重要理论基础,也为其他疾病遗传异质性的机制研究提供了新的思路。

当村寨(运动神经元,MN)面临猛兽来袭时(环境应激),村民(各种蛋白、RNA分子等)从四面八方赶来,唯村长(G3BP蛋白)马首是瞻,迅速集结成队伍(应激颗粒)以应对危机。此时,有一黑衣人(CMT致病蛋白)也混入人群,趁乱袭击了村长,破坏了村寨的防御体系,导致危机加剧。封面设计灵感来源于宋代名画《清明上河图》,装裱部分取材于“现代神经科学之父”圣地亚哥·拉蒙·卡哈尔(SantiagoRamónyCajal)所绘制的脊髓图谱中运动神经元所在区域。
在过去几十年的研究中,领域内逐渐形成了一个共识:大多数神经系统疾病的发生都是遗传因子和环境应激因子共同作用的结果。当细胞面临各种不良环境刺激时(如营养缺乏、高温、辐射等),细胞内一个重要的应激机制就是形成应激颗粒(Stressgranule,SG)。
SG是细胞内由RNA、蛋白翻译复合物和各种信号分子通过液-液相分离(liquid-liquidphaseseparation)组装形成的一种无膜细胞器。在应激状态下,SG的形成可以避免蛋白的错误翻译,有效地组织利用细胞中各种信号分子和能量资源,使细胞更好地应对环境中的不良刺激,提高细胞存活率。当环境压力解除后,细胞内的SG发生解聚,翻译复合物和各种信号分子迅速恢复功能,帮助细胞恢复正常运转。
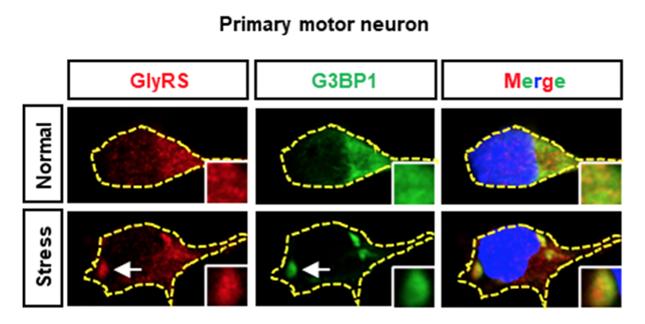
在应激情况下,原本弥散分布在细胞质中的G3BP蛋白迅速组装形成应激颗粒(如箭头所示绿色颗粒状结构),与此同时CMT2D致病蛋白GlyRS也被招募至其中(如箭头所示红色颗粒状结构)。蓝色部分为DAPI标记的细胞核。
在此项研究中,崔琴琴等研究人员首先以导致CMT2D亚型的甘氨酰tRNA合成酶(GIycyI-tRNAsynthetase,GIyRS)突变蛋白为切入点展开研究。当运动神经元面临不良环境刺激时,原本定位在细胞质中的GIyRS突变蛋白会进入新形成的SG中,并与SG中的核心蛋白G3BP发生异常相互作用(图2)。
研究人员通过活细胞荧光成像、邻近标记、定量蛋白质谱、STORM超分辨成像等技术发现,GIyRS突变蛋白与G3BP的异常相互作用不会影响SG组装——解聚的动态变化,却会显著干扰以G3BP为核心的SG蛋白网络,导致大量非SG组分异常滞留在SG中,从而扰乱细胞正常的应激反应,导致运动神经元抵御外界不良环境刺激的能力明显下降,更易发生轴突退变(图3)。
研究人员还进一步鉴定出GyRS突变蛋白与G3BP的结合位点位于其“内在无序区”(Intrinsicallydisorderedregion,IDR),通过破坏二者的异常结合,能够消除GIyRS突变蛋白对SG的干扰,改善运动神经元抵抗不良环境刺激的能力,有效缓解CMT2D小鼠模型的疾病症状(图3)。
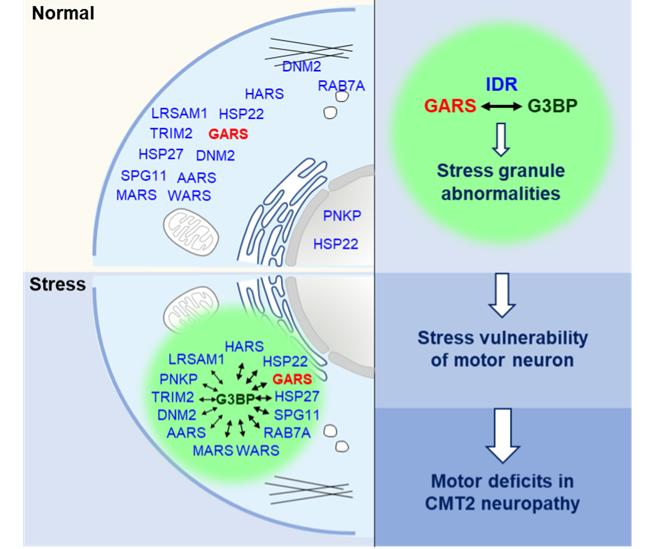
最后,研究人员还发现这个机制可以进一步扩展到其他CMT2亚型。通过对20几种不同类型CMT2致病蛋白进行测试,研究人员发现这些原本定位在细胞内不同部位的蛋白质,在应激条件下大部分都可以进入SG并且与G3BP发生异常相互作用,引起SG异常,导致运动神经元应对环境不良刺激的能力下降。这些发现表明,应激颗粒异常很可能是介导不同亚型CMT的共性致病机制(图3)。
该研究主要受国家自然科学基金委“原创探索计划”、“器官衰老与器官退行性变化的机制”重大研究计划、科技创新2030重大项目等资助。
论文链接:https://doi.org/10.1016/j.cell.2022.12.046
作者:刘海波
编辑:付鑫鑫
责任编辑:蒋萍
