4周减少超40%肝脏脂肪的长效疗法、实体瘤中达67%客观缓解率的TCR-T疗法... | 一周盘点
转自:药明康德
本期看点
1. T细胞受体T细胞(TCR-T)疗法IMA203单药治疗实体瘤患者,客观缓解率(ORR)高达67%。
2.用于治疗肝细胞癌的小分子PPARα拮抗剂TPST-1120早期临床数据亮眼,与标准治疗方案联用相比于单用标准治疗方案,ORR相对改善超74%。
3.新型长效GLP-1/胰高血糖素受体激动剂DD01治疗非酒精性脂肪肝(NAFLD)患者,在4周内使高剂量组的所有受试者的肝脏脂肪均减少超过40%。
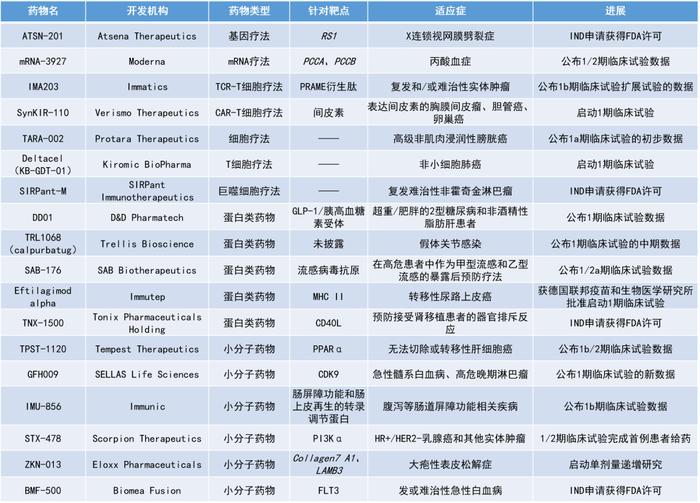
IMA203:公布1b期临床试验扩展试验的数据

Immatics公司公布了正在进行的1b剂量扩展试验,队列A中11名复发和/或难治性实体瘤患者接受T细胞受体T细胞(TCR-T)疗法IMA203单药治疗的最新临床数据。IMA203是由Immatics专有ACTengine平台所开发的TCR-T细胞,靶向由HLA-A*02呈递的黑素瘤抗原PRAME。PRAME是一种在各种实体瘤中经常表达的蛋白质,因此IMA203具潜力治疗广泛的癌症患者群体。
此次公布的数据显示,IMA203产生了高度深入和持久的客观缓解,经确认的客观缓解率为67%(6/9),产生缓解的病患涵盖多种肿瘤类型,包括两个治疗后超过9个月仍持续的经确认部分缓解(cPR)。此外,IMA2032还展现出良好的耐受性。Immatics计划在2023年第四季度公布下一次更新的数据,并同时计划注册导向的试验。
TPST-1120:公布1b/2期临床试验数据

TempestTherapeutics公司公布了其在研的小分子PPARα拮抗剂TPST-1120用于治疗肝细胞癌的1b/2期临床试验的积极早期结果。TPST-1120是一种口服、选择性PPARα小分子拮抗剂。临床前数据显示,TPST-1120可直接杀死肿瘤细胞,并靶向肿瘤微环境中的抑制性免疫通路。这两种类型中的靶向细胞皆依赖脂肪酸代谢,该代谢过程由PPARα转录因子调节。在一项针对接受过多次治疗的晚期实体瘤患者的1期临床试验中,TPST-1120单药治疗和与PD-1抑制剂nivolumab联合应用均导致肿瘤缩小及生物标志物的变化。
此次公布的结果显示,与标准治疗方案相比,TPST-1120与标准治疗方案联合疗法,在无法切除或转移性肝细胞癌患者的一线治疗中,在ORR上有显著改善,并展现出良好的安全性。TPST-1120三联治疗组的未经证实缓解率为30%(12/40),与对照组(17.2%,5/29)相比,ORR相对改善了74.4%。TPST-1120三联治疗组经证实的缓解率为17.5%(7/40),与对照组(10.3%,3/29)相比,ORR相对改善了69.9%。
DD01:公布1期临床试验数据

D&DPharmatech公司公布了其长效GLP-1/胰高血糖素受体双重激动剂DD01在1期临床试验中的结果。该候选疗法旨在快速解决脂肪肝问题,改善血糖控制,并减轻伴有或不伴有2型糖尿病和肥胖的脂肪肝患者的体重。
结果显示,DD01在高效降低脂肪肝的剂量下是安全和可耐受的。使用磁共振成像-质子密度脂肪分数(MRI-PDFF)进行评估,仅接受4周的治疗后,高剂量组的所有受试者与基线时相比均实现了至少40%的肝脏脂肪降低,平均降低超过50%,而安慰剂组受试者的肝脏脂肪相对于基线的变化<5%(p<0.0001)。DD01提供了一种独特的GLP-1/胰高血糖素活性平衡,在体重没有减轻的情况下,也能快速降低肝脏脂肪,因此具有独立于胰高血糖素单独治疗需要长期治疗才能实现相同效果的潜力。
ATSN-201:IND申请获得FDA许可
ATSN-201是AtsenaTherapeutics公司利用其新型扩散衣壳AAV.SPR开发的基因疗法,用于治疗X连锁视网膜劈裂症(XLRS)。XLRS是由RS1基因的突变引起的,该基因编码一种名为retinoschisin的蛋白,这是一种主要由光感受器分泌的蛋白质,位于视杆细胞、视锥细胞和双极细胞的外表面。XLRS的特点是视网膜层的异常分裂,这会导致视力受损,且无法通过眼镜矫正,随后会导致进行性的视力丧失。该病目前尚无批准的治疗方法。
ATSN-201使用的病毒衣壳能够横向扩散到视网膜下注射点以外的位置,实现对中央视网膜的安全和有效的基因递送(在XLRS患者的视网膜中,分裂腔主要集中在中央视网膜部位)。此前的研究显示,AAV.SPR在临床剂量下能够有效递送载荷至视网膜中央凹上的视锥细胞,无需手术分离,并且不会引起炎症。
mRNA-3927:公布1/2期临床试验数据
Moderna公司公布了其用于治疗丙酸血症(PA)的在研mRNA疗法mRNA-3927的早期临床数据。PA是由丙酰辅酶A羧化酶(PCC)的α或β亚基(分别由PCCA和PCCB基因编码)的致病变异引起的,这些变异会导致PCC缺乏,并使有毒的代谢物积累。该病的特点是反复出现的危及生命的代谢失代偿事件(MDE)和多系统并发症。目前,没有针对PA的根本原因的有效治疗方法。
mRNA-3927是一款由两种编码正常人类PCCA和PCCB亚基的mRNA组成的疗法,能够帮助细胞在体内合成具有活性的PCC蛋白酶。此次公布的结果显示,在完成了5个剂量组的招募后,独立的数据监察委员会没有观察到与mRNA-3927相关的剂量限制性安全信号,该候选疗法的1/2期试验进入了剂量扩展阶段,以确定推荐的剂量。
TARA-002:公布1a期临床试验的初步数据
ProtaraTherapeutics公司公布了其用于治疗高级非肌肉浸润性膀胱癌(NMIBC)的在研细胞疗法TARA-002的1a期临床试验数据。结果显示,TARA-002在NMIBC患者中的耐受性良好,在所有3名可评估的原位癌患者中观察到了抗肿瘤活性。其中,一名此前接受过多线治疗且对卡介苗无反应的患者获得了完全缓解,在另外两名患者中观察到了肿瘤的消退。
SIRPant-M:IND申请获得FDA许可
SIRPant-M是SIRPantImmunotherapeutics公司开发的自体SIRPαlow活化巨噬细胞疗法,用于治疗侵袭性的肿瘤。该疗法采用SIRPant专有的巨噬细胞激活解决方案PhagoAct来激活巨噬细胞,使其能够通过多重途径同时攻击癌细胞,从而激发针对肿瘤新抗原的多克隆T细胞和抗体反应。通过动员细胞免疫和体液免疫,SIRPant-M能够产生持久的多克隆免疫记忆,对癌症进行攻击。该公司预计在今年第三季度启动针对复发难治性非霍奇金淋巴瘤患者的1期多中心研究。
TRL1068(calpurbatug):公布1期临床试验的中期数据
TrellisBioscience公司公布了其新型天然人单克隆抗体TRL1068(calpurbatug)在假体关节感染(PJI)患者中进行的1期临床试验的中期数据。TRL1068具有破坏细菌生物膜的潜力,从而使难以治疗的细菌感染能够用标准抗生素疗法进行治疗。
此次公布的结果显示,在接受标准抗生素和单次TRL1068治疗的PJI患者中,75%的患者在治疗仅7天后,细菌生物膜负荷低于100CFU/mL超声处理液。虽然样本量较小(n=8),但这一发现与历史数据相比非常有利,因为仅有15%的PJI患者可以低于这个指标。值得注意的是,有四分之一接受TRL1068治疗的患者在治疗仅7天后,细菌生物膜负荷已低于检测下限。此外,TRL1068在两种剂量下均耐受良好,没有与药物相关的不良事件发生。
SAB-176:公布1/2a期临床试验数据
SABBiotherapeutics公司公布了其在研流感疗法SAB-176的早期临床试验数据。SAB-176是一款潜在“first-in-class”的完全人源化多克隆抗体,可以识别多个流感病毒抗原表位,提供对多种流感病毒株的保护。该疗法于近期获得了FDA授予的突破性疗法认定。在临床前研究中,SAB-176和奥司他韦的联合治疗显示出有希望的结果。此次公布的结果显示,SAB-176表现出良好的安全性和有效性。
TNX-1500:IND申请获得FDA许可
TNX-1500是TonixPharmaceuticalsHolding公司开发的第三代可与CD40配体(CD40L,也被称为CD154)相互作用的人源化单克隆抗体,旨在预防同种异体移植物和异种移植物的排斥反应、治疗自身免疫性疾病以及预防造血干细胞移植后的移植物抗宿主病(GvHD)。TNX-1500通过蛋白质工程设计,可减少FcγRIIA结合,从而降低血栓形成的可能性。在非人类灵长类动物中进行的临床前研究中,TNX-1500显示出预防同种异体移植器官排斥反应的活性,并且具有良好的耐受性。该公司预计将在2023年第三季度启动TNX-1500的1期临床研究。
GFH009:公布1期临床试验的新数据
SELLASLifeSciences公司公布了其获独家授权的新一代高选择性CDK9小分子抑制剂GFH009在急性髓性白血病(AML)和高危晚期淋巴瘤患者中的1期临床试验数据。临床前实验数据显示,GFH009对CDK9蛋白的选择性抑制率超过其它CDK亚型100倍以上。
此次试验共有72名患者参加,最后一次评估时94%的患者依然存活,表明该治疗方案可能具有良好的生存益处。AML患者的骨髓母细胞显著减少(最高剂量组的消除率达到了77%),并产生了持久的完全缓解,无最小残留病状态持续超过6个月。此外,在97%的患者中观察到生物标志物MCL1和MYC的水平下降。在任何剂量水平上没有出现与GFH009相关的剂量限制性毒性或重大安全问题。
IMU-856:公布1b期临床试验数据
Immunic公司公布了其用于治疗腹泻等肠道屏障功能相关疾病的候选疗法IMU-856的1b期临床试验数据。IMU-856是Immunic从第一三共(DaiichiSankyo)获得独家许可的一种新颖的全身作用的小分子口服调节剂,靶向一种作为肠屏障功能和肠上皮再生的转录调节剂的蛋白质。
此次公布的数据显示,针对乳糜泻病理生理学的四个关键方面(保护肠道结构、改善患者症状、促进生物标志物反应、增强营养吸收),IMU-856相比安慰剂具有积极的效果。这一结果证实了IMU-856恢复肠道壁和肠道健康的能力。此外,在该研究中未发现任何安全性或耐受性问题。
BMF-500:IND申请获得FDA许可
BMF-500是BiomeaFusion公司基于其专有的FUSION系统开发的在研共价FLT3抑制剂,用于复发或难治性急性白血病的成年患者。FLT3是一种受体酪氨酸激酶(RTK),在未成熟血细胞的存活、增殖和分化中起着重要作用。FLT3基因突变发生在大约30%的急性髓系白血病(AML)患者中,可以驱动致癌信号。尽管FLT3特异性和泛酪氨酸激酶抑制剂已获得FDA批准用于AML的各种治疗,但这些药物产生的持久缓解率相对较低,在总生存率方面的改善需求仍未得到满足。
BMF-500是一种新型、口服可利用的、高效、具选择性的FLT3共价小分子抑制剂。此前的研究表明,BMF-500潜在的脱靶风险较小,对活化的FLT3突变(包括FLT3-ITD和各种酪氨酸激酶结构域突变)具有皮摩尔级的亲和力。在携带FLT3-ITD突变的AML小鼠模型中,BMF-500使小鼠的肿瘤完全消退,且不需要持续暴露即可维持疗效。
