临床CDK2抑制剂:选择性和有效性的趋势 | 「药时代靶点说」系列文章
转自:药时代
预计阅读时间: 11分钟
01
CDK2结构与功能

周期蛋白依赖性激酶(CDK),一个丝氨酸/苏氨酸家族激酶,在细胞周期调节和转录活性中起关键作用。CDK的活性取决于与它们相连的Cyclin亚基、非催化调节蛋白,它们会形成CDK-Cyclin异二聚体复合物,在调节不同的生物过程中起着至关重要的作用。例如血管生成、造血、基因转录、细胞凋亡、神经元活动、新陈代谢、DNA修复、胞吐作用、和精子发生等。
人类至今发现至少有9种CDKs,编号为CDK1-CDK9。在不同肿瘤细胞中细胞周期失调通常是伴随着CDK活性的改变和/或其相互作用蛋白质。为此,研发新型CDK的抑制剂成为人们对抗不同的恶性肿瘤的有效途径。
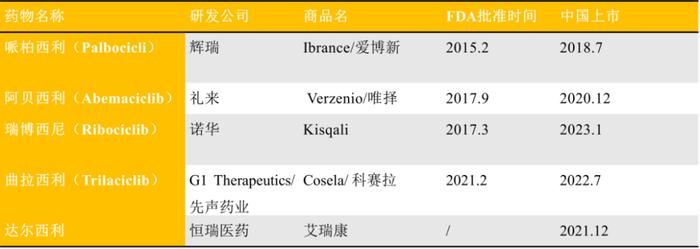
CDK抑制剂中对于CDK4/6的抑制剂较多,目前全球已上市5种的CDK4/6抑制剂,包括哌柏西利,阿贝西利,瑞博西尼,曲拉西利和达尔西利(图1),除了达尔西利仅在中国获批上市未披露销售数据外,其余4款的全球市场总规模基于最新财报数据已持续增长至近90亿美元。
CDK2的关键调节细胞周期蛋白是CyclinE1和E2,分别由CCNE1和CCNE2基因编码。虽然CDK2执行关键功能以促进进入细胞周期过程的S期,CyclinE/CDK2复合物在G1/S细胞周期过渡、中心体复制和组蛋白生物合成的调控中具有重要作用。
值得注意的是,通过CyclinsE-CDK2诱导的(Rb)磷酸化会导致G1转录因子E2F的释放,促进细胞分裂进入S期。此外,在早期S期的CyclinsA/CDK2激活引起内源性底物的磷酸化,导致DNA复制和E2F失活,从而使得S期的完成(图2)[1]。
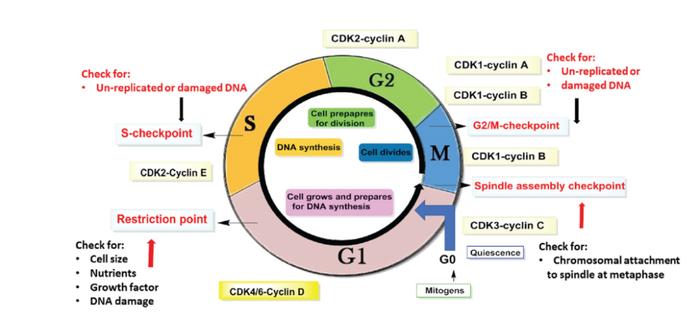
单体CDK2是一种典型的蛋白激酶,具有298氨基酸,折叠成典型双叶结构。具有较小的N末端叶,包含反平行五链β折叠和一个主要由α-螺旋组成的较大的C末端叶。实际上,两个终端域由单肽链连接作为铰链区,允许两个叶相对于彼此旋转而不破坏激酶的二级结构。
CDK2很早就被定为抗肿瘤药物研发的靶标,但最初的努力被停滞很大一部分原因是早期候选化合物的脱靶效应。最近,CDK2对肿瘤影响的新发现和有可能研发出选择性的CDK2抑制剂,如Incyte公司的INCN123667重新燃起了抑制CDK2的兴趣。在某些癌症背景下,E型和A型cyclins过度表达,CDK2过度激活,和临床前动物模型显示CDK2抑制会抑制肿瘤生长。数据表明CDK2还与特定类型肿瘤的增殖有关,例如卵巢肿瘤。此外,选择性CDK2抑制剂有可能对CDK4/6产生耐药性的癌症患者获益。
02
CDK2抑制剂重新分类
目前为止许多CDK2抑制剂已被发现,包括ATP竞争性或非ATP竞争性两大类。一方面,ATP竞争抑制剂受到了最多的关注,其中一些正在临床试验的各个阶段进行评估。另一方面,非ATP竞争性抑制剂,可抑制CDK2与Cyclin复合物和调控结合位点。因此,研究这些配体的结合模式以及CDK2的蛋白结构特征可以帮助我们更好地了解分子机制和调控这种蛋白激酶的活性。
尽管人们一直致力与开发CDK2抑制剂,目前,还没有CDK2选择性药物被批准上市。
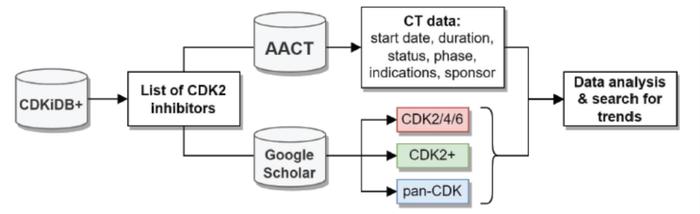
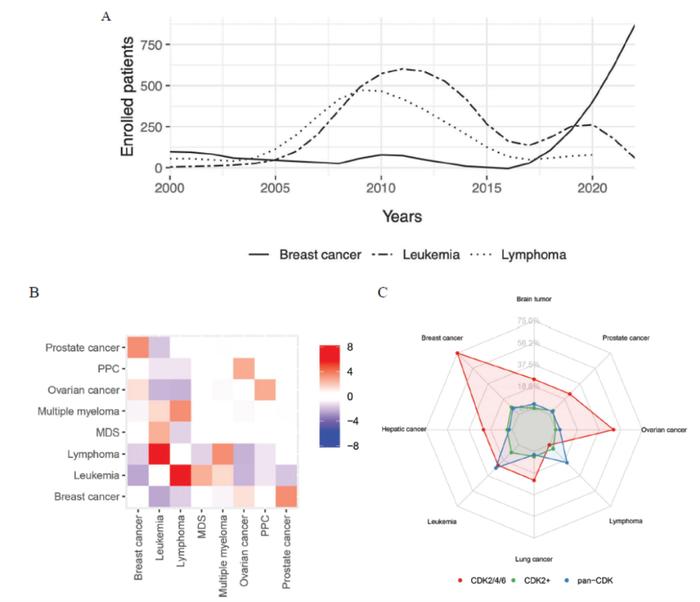
俄罗斯一个课题组使用临床试验综合分析数据库(AACT),分析了在二十年的过程中CDK2临床试验使用的抑制剂(图3)。
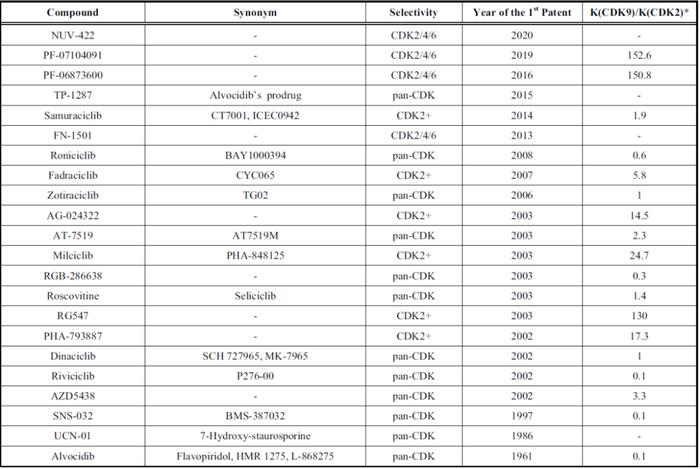
基于抑制剂的选择性特征,他们提出CDK2抑制剂分为三类:1)三重CDK2/4/6阻断剂,2)选择性的(抑制小于3种CDK2不相关激酶)和3)非选择性(panCDK)抑制剂(对除CDK2外的>4种CDK有效;IC50相差5倍)(图4)2。
03
临床适应症趋势
分析表明,泛CDK抑制剂研究先于选择性CDK2抑制剂。相比之下,评价CDK2/4/6抑制剂最近才开始,如辉瑞的PF-07104091等。
从历史上看,血液恶性肿瘤和乳腺癌是CDK2抑制剂的主要适应症。随着时间的推移,乳腺癌患者相对于白血病和淋巴瘤的趋势变得清晰(图5A):乳腺癌试验15项有6项(40%)的状态为“招募中活跃”,而淋巴瘤和白血病分别是33项试验中有一项(3%)和45项试验中有6项(13%)。有趣的是,当对CDK2抑制剂进行超过一种特定的测试时指示,疾病的组合不是随机的。事实上,同一种抑制剂最常在白血病和淋巴瘤试验,或者同时针对乳腺癌和前列腺癌进行测试(图5B)。
这些组合表明CDK2抑制剂有成为肿瘤类型特异性候选药物而不是细胞毒性药物。然而,适应症的选择是基于CDK2活性数据,并没有考虑特定肿瘤的性质。例如,CyclinE在乳腺癌标本中高表达,而在前列腺癌标表达不太明显。因此,治疗策略应同时考虑CDK2和CyclinE,因为这两个参数可能在个体肿瘤中表达有差异。
研究对CDK2具有不同选择性的抑制剂靶向不同肿瘤类型。如图5C所示,泛CDK和选择性CDK2抑制剂在多种肿瘤中进行临床试验。相比之下,三重CDK2/4/6抑制剂最常针对乳腺癌进行测试,在较小程度上针对卵巢癌进行测试。CDK2/4/6抑制剂在乳腺癌的使用趋势证实了肿瘤对CDK4/6抑制剂(例如,palbociclib或ribociclib)耐药可能会对CDK2抑制剂更加敏感。据报道,这些组合用于HR阳性、雌激素受体阳性和三阴性乳腺癌。CDK2/4/6抑制剂PF-06873600、NUV-422和PF-07104091目前正在接受针对乳腺癌的测试,而PF-06873600达到了针对HR阳性、HER2阴性乳腺癌患者的II期。
因此,三类具有不同选择性CDK2抑制剂经历了长达二十年的临床试验。不幸的是,最初开发的化合物具有有限选择性导致治疗剂量下出现毒性。这种不利现象的原因可能是针对CDK9,其在激活状态下的结合位点在结构上与CDK2很接近。实际上,palbociclib和ribociclib可以下调CDK9,这可能是一种2/3患者中性粒细胞减少的原因。
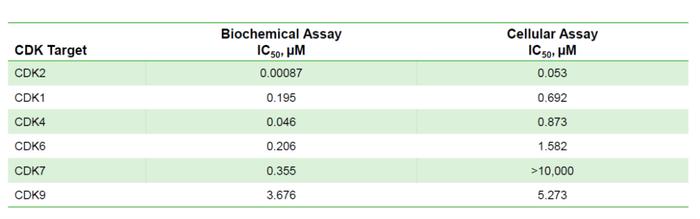
Incyte公司研发了一类新型的CDK2抑制剂INCB123667,但是结构还没披露。在临床前生化分析中,该小分子显示出对CDK2的选择性,而对CDK1、CDK4、CDK6、CDK7和CDK9无活性。此外,INCB123667通过抑制关键调节剂Rb来阻断CCNE1高表达细胞中的G1/S转换(图6)。
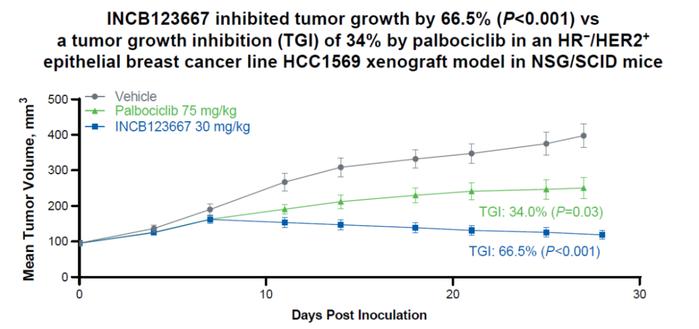
在体内验证中,研究人员在HCC1569细胞中评估了palbociclib(75mg/kg)与INCB123667(30mg/kg)的剂量,HCC1569是一种激素受体阴性、HER2阳性的上皮乳腺癌细胞系,CyclinE高表达。在28天的过程中,palbociclib的肿瘤生长抑制率为34%,而INCB123667为66.5%。这突出了CDK2抑制在CyclinE高的乳腺肿瘤模型中的功效(图7)。
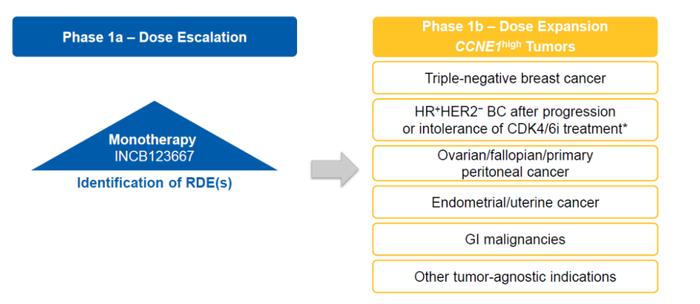
一项1a/b期临床试验(NCT05238922)已经启动,以评估INCB123667作为单一疗法治疗CCNE1高晚期恶性肿瘤患者。剂量递增阶段将确定推荐的扩展剂量和最大耐受剂量。随后将进行剂量扩展阶段,以探索INCB123667在包括TNBC在内的肿瘤特异性队列中的作用;CDK4/6治疗进展或不耐受后的激素受体阳性、HER2阴性乳腺癌;卵巢/输卵管/原发性腹膜癌;子宫内膜癌/子宫癌;胃肠道恶性肿瘤等。主要终点侧重于毒性,包括治疗中出现的不良事件的发生率,以及与之相关的剂量限制、减少、中断和停药。次要终点包括药代动力学、客观反应率、疾病控制反应和反应持续时间(图8)。招募工作正在进行中,估计招募了大约155名患者。
Blueprint的CDK2抑制剂BLU-222出于对眼部不良事件的担忧,FDA在2月份暂停了部分试验,但很快就取消了这一限制。在clinicaltrials.gov网站上,BLU-222正在针对多种癌症进行研究,包括乳腺癌、卵巢癌和胃癌等。预计将有366名患者参加该研究。不良事件与视力有关,报告了光敏感和视力模糊。Blueprint表示,事件通过减少剂量或停止治疗得到解决,没有观察到其他问题。
04
结论
总体而言,CDK2靶向药物的发展趋势是以选择性和定好特定肿瘤类型为主要方向。三重CDK2/4/6拮抗剂的出现主要是为了规避乳腺癌对CDK4/6抑制剂的耐药性患者。
此外,对于治疗CyclinE过度表达的肿瘤(如高度恶性浆液性卵巢癌)仍是临床未满足的需求。开发具有特定选择性cyclinE配体是一个挑战。最近选择性CDK2靶向新策略的最新发展,包括非ATP竞争性抑制剂和选择性降解剂,是有望助于CDK2靶向治疗的成功。
Reference
1.NajlaA.Alshaye.(2023) Synthesisand in vitro anticanceractivityofsome2-oxindolinederivativesaspotentialCDK2inhibitors. JournalofBiomolecularStructureandDynamics 0:0,pages1-14.
2.RusinaV.Polina,LisovA.Alexey,DenisovaA.Alexandra,GandalipovR.Erik,NovikovN.Fedor*,ShtilA.Alexander,ClinicalCDK2Inhibitors:TrendstoSelectivityandEfficacy,RecentPatentsonAnti-CancerDrugDiscovery2023;18(2).
3.其它公开资料
摘要图来源:123rf
