推荐阅读 | 2023年度FDA新药审批总结报告
转自:注册圈
2024年1月8日,FDA发布了2023年度新药审批总结报告,内容较多。笔者学习之后,仅对关注部分进行了总结,包括首创新药、审评方式和适应症等。
新冠疫情周期虽然结束,FDA作为公共卫生重要的监管者,仍关注新冠病毒的新进展,以及关注和支持这一领域的药物研发进展,未雨绸缪。
新药开发批准的领域不设上限,FDA关注任何一个领域。这对于创新药物的开发非常重要,监管机构的政策和方向有时会引领申请人的研发方向,不设限,并加以支持与鼓励,对于创新的探索非常重要。这也是FDA能作为全球卫生监管机构方向标的原因。FDA在生物类似药上的批准仍然加大支持,鼓励和支持医药公司加大这方面的研发。
2023行动计划中,包括新药批准和其它重要药物批准,重点关注疾病和病症的预防、诊断和治疗,例如:
传染病,包括COVID-19、呼吸道合胞病毒(RSV)、医院获得性和呼吸机相关性细菌性肺炎以及HIV-1。
神经系统疾病,例如肌萎缩侧索硬化症(ALS),阿尔茨海默病和偏头痛。
阿片类药物的使用、误用和滥用。
心脏、血液、肾脏和内分泌疾病,包括儿科2型糖尿病,多种类型的贫血,儿科激素缺乏症和慢性体重管理。
肺部疾病,例如哮喘和囊性纤维化。
胃肠道疾病,包括炎症性肠病和小儿功能性便秘。
不同类型的癌症,例如结直肠癌、前列腺癌、肺癌和低级别神经胶质瘤(起源于大脑的肿瘤)。
女性健康,例如产后抑郁症,更年期引起的潮热以及非处方口服避孕药。
FDA关注的疾病是当下卫生健康领域迫切的需求,要么疾病罕见,新药的研发有很高难度,要么有很大的流行病人数,是患者急切需要的。同时关注了女性健康和儿童健康的药物开发考量。这个世界是多彩的,不因为性别和年龄原因,忽视其它任何方面。
2023年,CDER批准了55个新药,或作为新药申请(NDA)下的新分子实体(NME)批准,或作为生物制品许可申请(BLA)下的新治疗性生物制品批准。创新药中的一种或多种活性成分之前从未在美国获得批准。
在这份报告中,FDA首先强调的是首创新药。
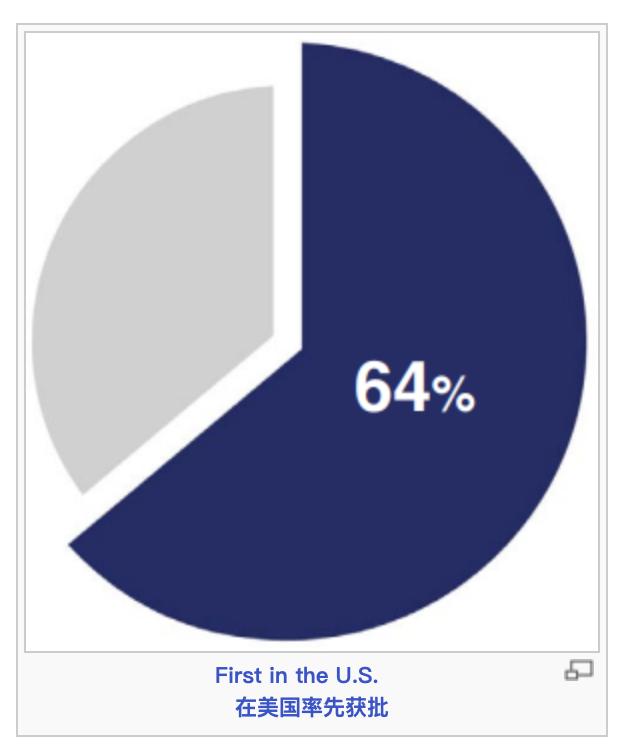
在2023年获批的55个新药中,CDER认定20个(36%)为首创药。这些药物具有不同于现有疗法的作用机制。
首创新药包括:
Daybue(trofinetide) 口服溶液,作为2岁及以上Rett综合征患者的首个治疗方法,Rett综合征是一种影响大脑发育的罕见遗传性神经系统疾病。
Jesduvroq(daprodustat) 片剂,作为接受透析至少四个月的成人慢性肾脏病引起的贫血(红细胞数量减少)的首个口服治疗。
Miebo(perfluorohexyloctane), 用于治疗干眼症的体征和症状的滴眼液,当患者的眼泪不能提供足够的眼部润滑时,会导致潜在的眼部(与眼部相关的)炎症和损伤。
Paxlovid(奈玛特韦和利托那韦,联合包装,口服使用) 片剂,用于治疗有进展为重症COVID-19(包括住院或死亡)高风险的轻度至中度COVID-19。Paxlovid是首个获批用于治疗成人COVID-19的口服抗病毒片剂。
Skyclarys(omaveloxolone) 胶囊,作为弗里德赖希共济失调的首个治疗方法,这是一种罕见的遗传性退行性疾病,会损害神经系统,以协调性受损和行走困难为特征。
Talvey(talquetamab-tgvs)注射剂,用于治疗接受过其它疗法的难治性或复发性多发性骨髓瘤成人患者。通过加速审批途径获得批准。
Veozah(fezolinetant) 片剂,用于治疗更年期引起的中度至重度血管舒缩症状或潮热。
Xdemvy(lotilaner) 眼用溶液,作为治疗蠕形螨性睑缘炎的首个药物,这是由毛囊蠕形螨(一种显微镜下螨)引起的慢性眼睑炎症。
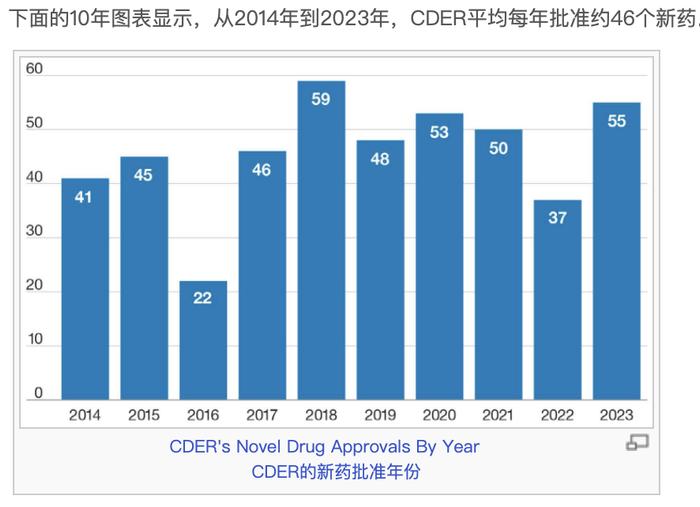
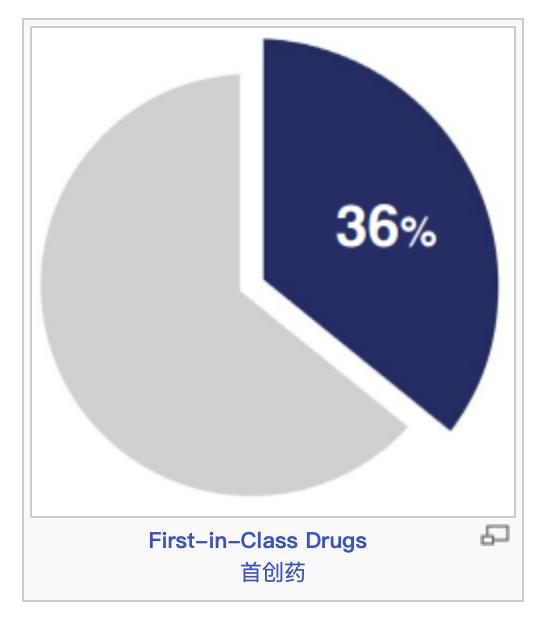
图1:2023年批准的55个新药中,有20个为首创药
其次,在2023年批准的新药中,FDA依然采取了多种灵活的审批方式,包括对于罕见病的药物开发,病人在市场上没药可用的情形是非常可怕,
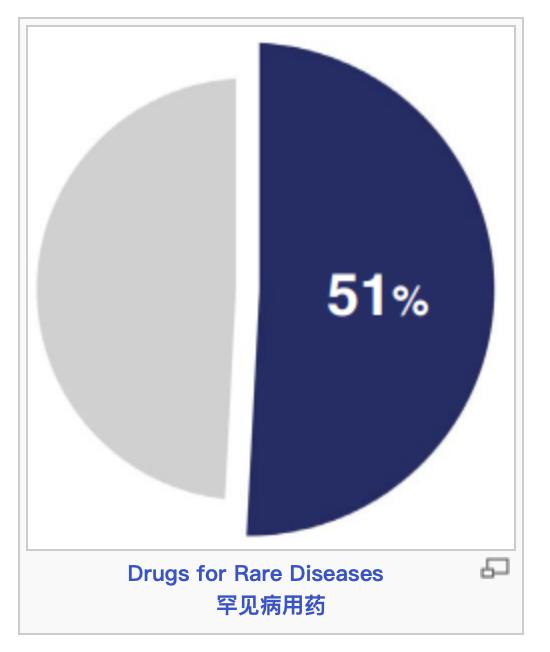
2023年,CDER批准的55个新药中,有28个(51%)获得了孤儿药认定,因为它们针对罕见病(在美国影响不到20万人的疾病)。罕见病患者通常很少或根本没有可用于治疗疾病的药物。
罕见病新药包括:
Fabhalta(iptacopan) 片剂,作为阵发性睡眠性血红蛋白尿症的首个口服治疗药,这是一种导致红细胞分裂的疾病。
Filspari(sparsentan) 片剂,可减少有疾病快速进展风险的原发性免疫球蛋白A(IgA)肾病成人患者的蛋白尿(尿蛋白升高)。IgA肾病是一种可导致肾衰竭的慢性肾脏疾病。Filspari通过加速审批途径获得批准。
Jaypirca(pirtobrutinib) 片剂,用于在接受其它疗法后治疗复发性或难治性套细胞淋巴瘤,一种侵袭性非霍奇金淋巴瘤。2023年晚些时候,CDER批准Jaypirca用于治疗接受其它疗法后的成人慢性淋巴细胞白血病或小淋巴细胞淋巴瘤。两种适应症均通过加速审批途径获得批准。
Joenja(leniolisib) 片剂,作为首个治疗12岁及以上患者活化磷酸肌醇3-激酶δ综合征(APDS)的药物。APDS是一种损害免疫系统的遗传性疾病。
Lamzede(velmanasealfa)注射剂,用于治疗α-甘露糖苷贮积症的非中枢神经系统表现,这是一种罕见的遗传性疾病,患者没有α-甘露糖苷酶。症状包括智力障碍、听力丧失、免疫系统减弱、面部特征独特、骨骼异常和肌肉无力。
Loqtorzi(toripalimab-tpzi)当与其他疗法一起或之后使用时,输注用于治疗复发性或转移性(扩散)鼻咽癌(NPC)。NPC是一种罕见的头颈部癌症。
Ogsiveo(nirogacestat) 片剂,治疗硬纤维瘤,这是结缔组织中的非癌性生长,例如腹部,手臂和腿部。
Ojjaara(momelotinib) 片剂,用于治疗骨髓纤维化,骨髓纤维化是一种骨髓癌,会导致骨髓中瘢痕组织积聚,破坏人体正常的血细胞生成。
Rezzayo(rezafungin) 注射剂,用于治疗18岁或18岁以上患者的念珠菌血症和侵袭性念珠菌病,这是严重且危及生命的真菌感染,替代疗法有限或没有替代疗法。
Rystiggo(rozanolixizumab-noli) 注射剂,用于患有全身性重症肌无力的两种最常见亚型的成人,这是一种导致肌肉无力和严重疲劳的慢性自身免疫性神经肌肉疾病。
Sohonos(palovarotene) 胶囊,用于减少8岁及以上女性和10岁及以上男性进行性骨化纤维发育不良中新异位骨化(骨骼外骨形成)的体积,这是一种骨骼在肌肉组织和结缔组织中逐渐形成的疾病。
Veopoz(pozelimab) 注射剂,作为首个治疗CHAPLE病的药物,CHAPLE病是一种非常罕见的遗传病。CHAPLE病会影响免疫系统,并可能危及生命。
Wainua(eplontersen) 注射剂,用于治疗遗传性转甲状腺素蛋白介导的淀粉样变性,这是一种导致器官和组织功能障碍的遗传性疾病。
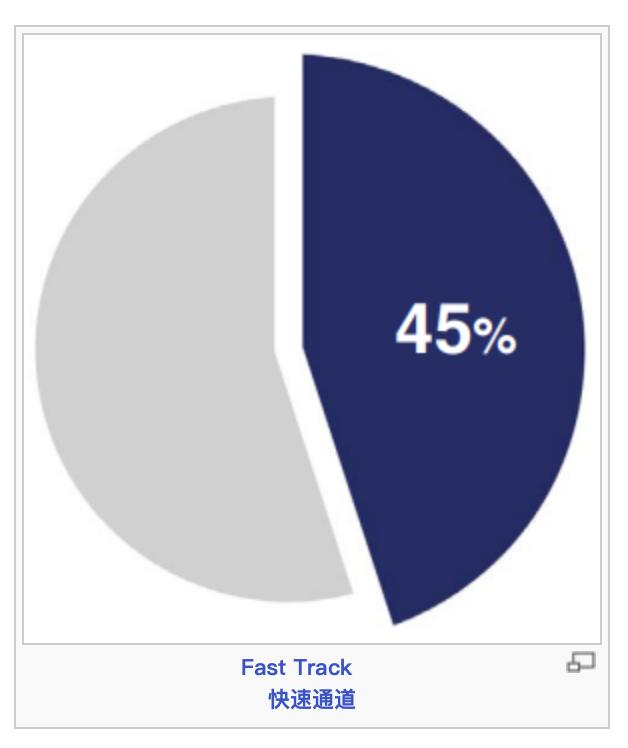
第三,FDA一直强调,加快创新药的审评,尽快满足患者未被满足的临床需求,这一宗旨不断得到强化。FDA使用了多种加快开发和审评路径,包括快速通道认定,突破性治疗,优先审评,加速批准。2023年获批的55个新药中,有36个(65%)使用了一个或多个加快计划,具体而言是快速通道认定、突破性治疗认定、优先审评认定或加速审批。
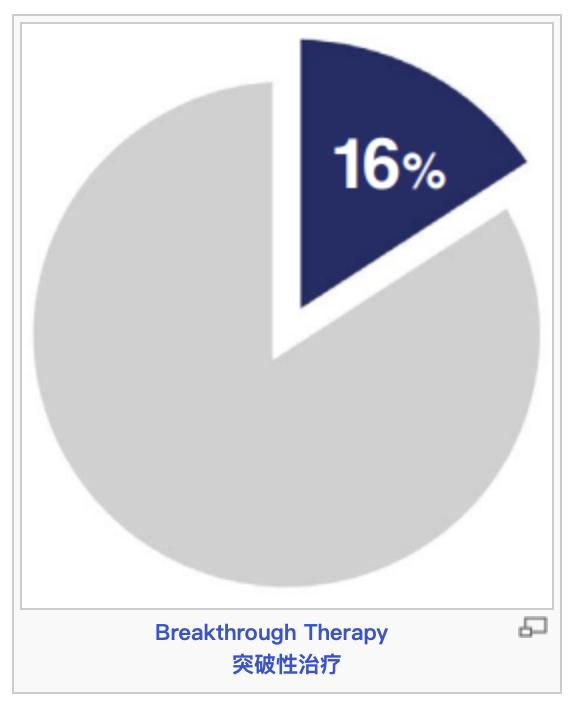
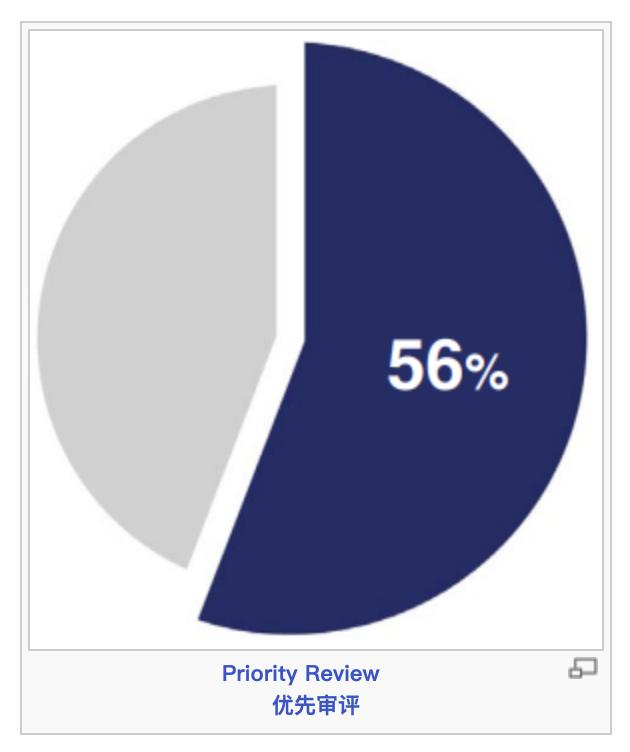
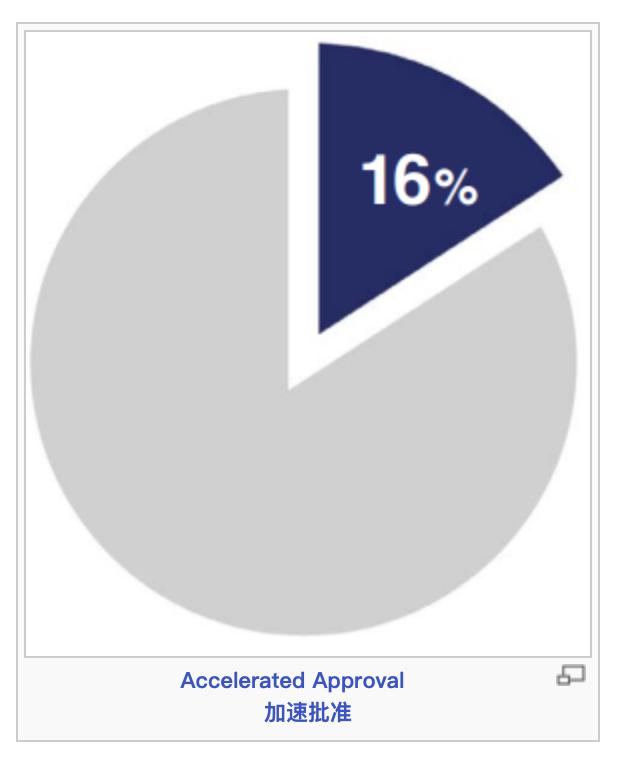
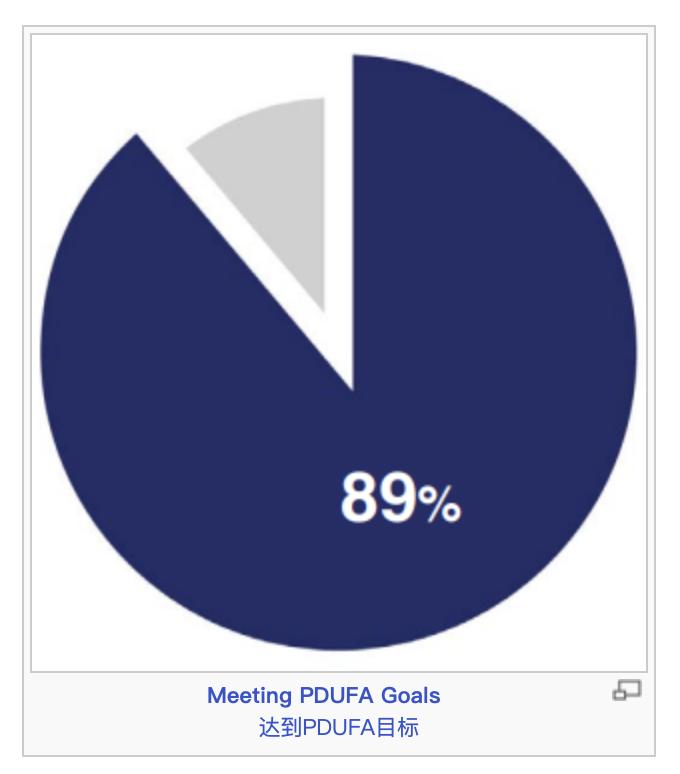
根据PDUFA,行业使用者付费,为CDER提供资源以扩展审评活动的能力。在PDUFA下,在特定的时间范围对申请进行审评。整个2023年,CDER对89%(55个中的49个)批准的新药达到或超过了PDUFA的目标日期。
2023年的55个新药中,CDER在“首轮”审评中批准了46个(84%)。这一高百分比在一定程度上反映了CDER工作人员在多大程度上就支持全面和综合药品审评所必要的研究设计要素以及药物申请所需的其它数据,向药物研发人员提供了清晰的说明。
以下是2023CDER批准的已获批药品的新用途或新适应症:
·Ayvakit(avapritinib) 片剂,于2020年首次获批用于治疗各类胃肠道间质瘤。Ayvakit于2023年被批准用于治疗惰性系统性肥大细胞增多症,这是一种导致过多肥大细胞(一种白细胞)积聚的罕见疾病。
·Eylea(aflibercept) 注射剂,最初于2011年被批准用于新生血管性(湿性)年龄相关性黄斑变性。2023年,CDER批准Eylea用于治疗早产儿视网膜病变(ROP),这是一种可能发生在早产儿身上的眼部疾病。在ROP中,异常血管在视网膜中生长,可导致视力丧失。
·Ilaris(canakinumab) 注射剂,最初于2009年获批。2023年,CDER批准Ilaris用于治疗不建议使用某些其它疗法的成人痛风发作。痛风是一种关节炎,其特征是一个或多个关节突然出现疼痛、肿胀和发红。
·Jemperli(dostarlimab-gxly) 注射剂,最初于2021年获批。2023年,CDER批准Jemperli作为单药以及与其它疗法联合使用,治疗两种子宫内膜癌。子宫内膜癌发生在子宫内膜组织中。
·Kevzara(sarilumab) 注射剂,于2017年首次获批用于治疗中度至重度活动性类风湿关节炎。2023年,CDER批准将其用于对皮质类固醇没有充分反应或不能耐受皮质类固醇逐渐减量(逐渐减量)的风湿性多肌痛(PMR)成人患者。PMR是一种炎症性疾病,会导致肩膀和臀部周围的肌肉疼痛和僵硬。
·Keytruda(pembrolizumab) 注射剂,于2014年首次获批。2023年,CDER批准了Keytruda的几个新用途,包括与Padcev联合用于不符合某种化疗条件的局部晚期或转移性尿路上皮癌患者;作为非小细胞肺癌的辅助治疗(在其他治疗后);作为新佐剂(在其它疗法之前)和辅助治疗用于早期非小细胞肺癌。
·Linzess(linaclotide) 胶囊,于2012年首次获批。2023年,CDER批准其为首个治疗6至17岁儿童功能性便秘的药物。小儿功能性便秘发生在患者排便不频繁且大便坚硬、排便困难或排便疼痛时。
·Lonsurf(tipiracilhydrochloride和trifluridine) 片剂,于2015年首次获批。2023年,CDER批准Lonsurf单独或与另一种疗法(bevacizumab)联合用于先前治疗过的转移性结直肠癌患者。
·Lynparza(olaparib) 片剂,于2014年首次获批。2023年,Lynparza被批准与另一种疗法联合用于患有转移性和去势抵抗性的成人前列腺癌(即当睾酮水平降低至极低水平时继续增长)。
·Padcev(enfortumabvedotin-ejfv) 注射剂,于2019年作为单药首次获批。CDER于2023年批准Padcev与Keytruda联合用于治疗成人局部晚期或转移性尿路上皮癌。
·Polivy(polatuzumabvedotin-piiq) 注射剂,于2019年首次获批用于治疗至少两种疗法后的成人复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)。2023年,CDER将适应症扩大至既往未经治疗、未特别指明的DLBCL或被认为中低风险或更高风险的高级别B细胞淋巴瘤的成人患者。
·Rexulti(brexpiprazole) 片剂,最初于2015年被批准作为重度抑郁症的附加疗法和精神分裂症的疗法。2023年,CDER批准Rexulti作为首个治疗阿尔茨海默病所致痴呆相关焦虑症的药物。
·Rinvoq(upadacitinib) 片剂,最初于2019年获批用于成人中度至重度活动性类风湿关节炎。2023年,CDER批准Rinvoq用于治疗对其它疗法(特别是TNF阻滞剂)反应不充分或不耐受的中重度活动期克罗恩病成人患者。Rinvoq是首个获批治疗中度至重度活动性克罗恩病的口服产品,克罗恩病是一种引起消化道炎症的慢性疾病。
·Talzenna(talazoparib) 胶囊,于2018年首次被批准用于治疗多种类型的乳腺癌。2023年,Talzenna被批准与另一种疗法联合治疗一种转移性去势抵抗性前列腺癌。
·Tukysa(tucatinib) 片剂,于2020年首次获批。2023年,CDER批准Tukysa用于治疗一种在某些化疗后进展的结直肠癌。
·Verzenio(abemaciclib)片剂,于2017年首次获批。2023年,CDER批准Verzenio与内分泌治疗(他莫昔芬或芳香化酶抑制剂)一起用于治疗一种高复发风险的早期乳腺癌。
在2023年批准的药品中,有药品被扩大至包括新儿科人群使用。2023年,CDER还批准了5个参照产品的5个生物类似药。
《联邦食品、药品和化妆品法案》(FD&C法案)第505B节(通常被称为最初创立它的法案名称,即《儿科研究公平法案》或PREA)和FD&C法案第505A节(通常被称为最初创立它的法案名称,即《儿童最佳药品法案》或BPCA)赋予CDER在某些情况下要求(PREA)或请求(BPCA)开展儿科研究的权力。这两项法律在很大程度上促成了在许多药品说明书中纳入儿科信息。
药品申请的审评,无论是新药批准还是补充批准,都是一个协作、协调良好的过程,涉及CDER整个部门,有时甚至涉及FDA其它部门的科学、监管和政策专家。对于每个申请,FDA都会对安全性和有效性数据进行非常仔细和勤勉的分析,包括将疾病或病症的严重程度、当前可用的治疗方案以及预期患者人群考虑在内的获益-风险分析。如果治疗产品符合批准标准,我们必须就适应症、标签、安全性问题和其它考虑因素达成一致。
报告中,FDA提到经常咨询参与药物开发和审评的外部科学专家、患者和患者权益倡导者、行业代表、学者和其他社区成员。这些各方都有其独特的专业知识和观点,我们会考虑他们的观点。我们认真对待监管决策,因为我们知道我们的决定会影响全国患者和消费者的健康和福祉。
参考文献:
2023年FDA新药审批总结报告,2023.1.10,识林
