思辨创新中药临床研究难点与机遇
中药临床研究一直是中药产业健康发展的短板,该领域对科学性认识相对不足、技术手段较为缺乏,在研究开展的合规性上也难以保证。本文通过对中药新药临床研究的历史进行简单回顾,粗略分析新的历史机遇下中药新药临床研究的难点、痛点,透视药物临床试验“贵在设计、难在实施、重在评价”在中药临床的运用,尝试寻找其发展机遇。
新药注册情况梳理
2016年以来,党中央、国务院,国家药监局、国家中医药局、国家医保局持续出台了鼓励中医药产业发展的政策,2007年、2008年以来低迷的中药工业产值2019年触底回升,在2022年、2023年连续两年增速超过化学药和生物药,成为医药板块中营收、利润均正增长的领域。
随着人口老龄化,中药治疗慢病、多病、未病的优势凸显,随着医疗的目标从治疗疾病转向健康生活,中药的优势更加展露出来。
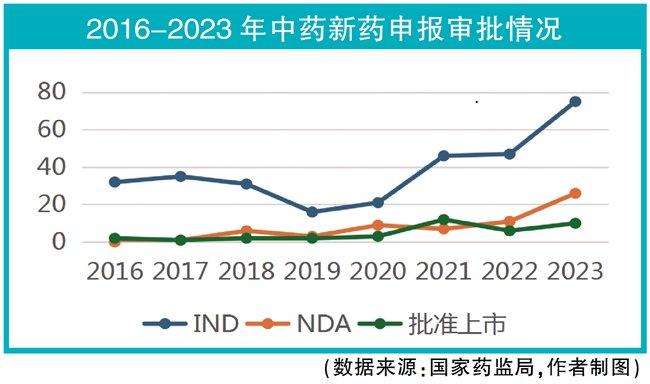
在此大趋势下,中药新药申请临床,完成临床申请上市以及批准上市的数量自2016年、2017年触底回升,但由于新药研发周期长的原因,回升速度还较缓慢,绝对数量较少。
从数量上看,中药新药申请临床的数量从2020年开始提速,一方面是2019年出台的鼓励政策让企业有了信心;另一方面是临床试验默示许可让中药临床申请的通过率由持续了近20年的50%左右变成了几乎100%。由于临床试验周期长的原因,申请生产的数量并没有与申请临床的数量一并增加。
2024年8月,2.1类改良药万通筋骨巴布膏报产未获批准。紧随其后,1.1类新药椒七麝凝胶贴膏因为需要进一步完善临床试验数据撤回,临床试验登记网站显示其于2023年重新完成了Ⅲ期临床试验。
数据显示:品种绝对数、IND和NDA曲线分离、以2024年的数据看完成Ⅲ期临床品种的通过率等,尽管这些信息有局限性,但提示一个行业的再出发是不易的,有行业体量的因素、也有行业本身还困于方法和标准的原因。
机遇与挑战并存
过去几十年,我国的生物医药产业发展过程是一个逐步学习的过程,期间化学药、生物药和中药的研发取得了长足的发展,逐步由医药大国向医药强国迈进。但是中药新药临床也面临一定挑战。
2019年以来提出健全符合中药特点的审评审批体系要求,为中药新药的发展指明了方向,中医药产业的发展迎来了巨大的历史机遇:
首先是经济的发展和人口结构的变化带来医疗的逻辑从挽救生命向健康生活转变,契合了中医药之所长;其次是政策驱动,中医药的复兴是民族复兴的一部分,既包含科学又包含文化。从技术层面上,建立适合中医药特点的方法和模式成为共识,从中药注册审评审批技术层面上,新的中药注册分类开始实施,基于“三结合”审评证据体系、人用经验、真实世界研究相关的指导原则陆续发布和实施,这些管理规定和技术指南,充分尊重了中药本身来自临床又回归临床的优势和特点,给出了基于人用基础,免除药效学甚至Ⅰ、Ⅱ期临床的可能性,这将为中药新药的研究节约大量的时间和资源。
抓住机遇的同时,也会面临挑战。
第一,中药发展面临临床证据不足和临床数据缺乏信任的两大痛点。由于历史原因,目前上市约10000个品种的中成药中大部分缺乏临床数据,需要重新定位并通过临床研究获取高质量的临床证据,这是中药大品种培育必须迈过的门槛。一些有先见之明的企业已经启动了某些中药品种几千甚至上万例的循证研究。
第二,提出“适合中医药特点”的评价方法,但是落实到操作层面的指南、方法、规则还十分欠缺,“安全、有效、质量可控”的药品基本要求与中医药传承创新发展独特的理论体系和实践特点有机结合还需要建立范式。尤其证候类中药临床研究更加复杂,虽然《证候类中药新药临床研究技术指导原则》2018年就发布,但行业仍在探索,目前进入临床阶段的几个证候类中药研究进展并不顺利。
第三,新工具、新标准、新方法的建立和实现需要较长时间。中医药有独特的理论体系和临床定位,相对于化学药,中药更多的需要居家、长疗程的服用,其评价指标可能意味着更大的数据量,患者是否按时按量服药等实施过程质量控制难度更大,因此需要开发新工具,将主观指标尽可能客观化,同时实现数据的远程、持续的数据记录和患者依从性管理。因此需要开发新工具,以实现数据记录并将主观指标尽可能客观化。工具的开发需要时间,工具本身的可靠性也待确认。新工具、新标准、新方法的应用还将面临审评部门的考验,这也让产业界在引进这些工具、方法的时候有许多顾虑。
第四,研究质量依然是中药临床试验的薄弱环节。质量要求是横跨在医学之上的跨学科、统一的度量衡系统,这个系统对任何医学体系都是同等的、公平的,目前中药新药临床研究中数据的真实性问题已经基本解决,但是准确、及时、可靠、过程合规等问题依然存在,这也将直接影响到数据质量并最终影响审评审批。
把握中药鲜明特色
药物临床试验“贵在设计、难在实施、重在评价”,是药品研发花费最多环节的高度概括。中药临床证据的收集需要在临床试验设计、实施、评价各方面共同发力,达成共识,阐释中药特点及有效性和安全性优势,构建符合中药特点的审评审批体系。
中药的临床研究,首先在于临床定位,每项中药临床设计之初,都需要了解疾病现有的治疗进展,明确西医的治疗和中医的治疗在不同疾病或同一疾病的不同阶段的角色定位,发挥各自优势,真正解决未满足的临床需求。随着医学的进展,许多中药治疗的优势领域已经被西药追平,如慢性胃炎一直被认为是中药的优势领域,但实际上随着制酸药和根除幽门螺杆菌三联、四联疗法的应用,中药治疗对明确到功能性消化不良阶段的慢性胃炎才具有优势,而同类已上市中成药已经不下30种,开发此类中药新药需要在分析了解大量已上市药物特点基础上精准定位、细分人群。
从具体设计上,中药新药的临床研究不必也不应该套用化药的评价指标,但临床试验在不同研究阶段应当回答的问题,如指标设计、观测与评价方法、数据管理和统计分析等应当遵循的原则是一样的,以样本量为例,至今很多中药新药临床试验仍然围绕Ⅱ期200例,Ⅲ期400例在做,并没有遵循科学的设计原则。“人用经验”是中药的特点和优点,“三结合”的证据体系的目的也不是要减少研究,更不是降低标准。中药相关新政涉及的不同是提供证据的来源,但药物不同临床阶段要回答的问题没有变,临床研究背后的科学逻辑没有变,对证据质量的要求更不可能变。
★★★结语★★★
总之,中药高质量发展已迎来重要的历史机遇,补齐临床数据短板是中药临床研究和探索的重要试验场和机遇,加之基于“三结合”审评证据体系、人用经验、真实世界研究等政策法规鼓励以及现实需求等,必将开辟具有中医药特色的中药临床研究和注册审批路径。
