科学家发现FcuR识别不同形式免疫球蛋白M的分子机制,助力于理解生物学功能
来源:DeepTech深科技
免疫球蛋白M(IgM)是人体内五类免疫球蛋白的其中一个,是机体在受到病原体刺激之后产生的第一类抗体,因而被称为体液免疫的“先锋部队”。同时,IgM在人体中会以多种形式存在。
2020年,北京大学肖俊宇教授课题组在Science发文,报道了IgM五聚体与分泌组分形成复合体的结构,阐明了IgM五聚体组装和黏膜转运的分子机制。
每一类免疫球蛋白都有其相应的Fc受体,这些受体通过与相应免疫球蛋白的Fc区域进行特异性的相互作用,从而引发不同的信号通路和免疫反应,包括参与调节免疫应答、介导细胞毒性等。
相比其他免疫球蛋白的Fc受体,IgM的Fc受体被发现得比较晚。直到2009年,科学家才发现之前被称为Toso或Faim3的蛋白,是哺乳动物中唯一的IgM特异性受体,并据此将其重新命名为FcμR。
FcuR主要存在于B细胞、T细胞和自然杀伤细胞(NK,naturalkillercell)表面,并在慢性淋巴细胞性白血病CLL(chroniclymphocyticleukemia)病人的B细胞中有着高度表达。
除了识别血清中的IgM抗体,2015年一支中国团队报道FcμR还可以结合B细胞受体(BCR)复合体中的膜型IgM。后来,来自美国的课题组进一步证实了该发现。
2021年,科学家还发现FcμR可以与包含分泌组分的黏膜上的IgM结合,并介导其反向胞移过程。
被敲除FcμR基因的小鼠,呈现边缘区B细胞减少、自身抗体增加等免疫表型。但是,对于FcμR发挥功能的分子机制学界至今没有弄清楚。
在近期一项工作里,针对FcμR如何在分子层面发挥功能、以及如何对不同形式的IgM进行识别,肖俊宇课题组开展了研究。
总之,本次成果通过结构生物学、生物化学和细胞生物学等手段,揭示了FcμR可以特异性地感知不同形式的IgM,为深入理解IgM的生物学功能奠定了基础。
近年来,在与FcμR相关的疾病研究中,慢性淋巴细胞性白血病(CLL,chroniclymphocyticleukemia)受到了不少关注。
CLL是一种B淋巴细胞恶性肿瘤,和其他种类的B淋巴细胞癌相比,CLL中FcμR表达量异常增高。但是,FcμR在CLL发病过程中的作用机制尚不清楚。
之前有科学家基于FcμR与IgM的相互作用,设计了靶向CLL细胞中的FcμR的免疫疗法,实现了定向清除FcμR高表达的CLL细胞。
而FcμR与IgM复合体结构的解析,将有助于为相关免疫疗法的设计和优化提供新思路。
据了解,肖俊宇课题组长期专注于免疫球蛋白与受体的相互作用机制研究,曾于2020年首次报道了IgM与多聚免疫球蛋白受体pIgR的复合体结构。这一成果也促使他们对IgM与其他受体分子的相互作用开展研究。
本研究大概起始于2019年下半年,期间经历了分子相互作用的验证、复合体组装和结构的解析与分析、结构和功能之间的相关性验证、以及针对新发现开展延伸探索等。
2021年11月,经过长达两年的探索,课题组获得了FcμR-D1与IgM-Cμ4的复合体晶体结构、以及IgM五聚体与FcμR的两种结合比例的冷冻电镜结构,并认为这已经是一个逻辑较为完整的故事。
2021年11月的某一天,当他们像往常一样浏览与领域内的新进展时,看到了一篇发表在CellReports上的论文。
该论文报道了如下内容:FcμR可以与包含分泌组分的黏膜上的IgM结合,并介导其反向胞移过程。
看到这一发现,肖俊宇团队展开了如下讨论:“我们的研究发现:FcμR的高亲和力位点、与分泌型IgM中分泌成分的结合位点是基本重叠的。那么,FcμR是如何结合分泌型IgM的?”
为了回答这一问题,他们首先在体外验证了二者之间的相互作用,并经过一系列摸索获得了该复合体的冷冻电镜结构,借此完成了IgM与FcμR相互作用机制研究的最后一块拼图。
“科学之间总是相互促进,业界同仁在CellReports报道的结果启迪了我们的研究,相信我们的论文也会在某一时刻为他人研究提供线索与帮助。”该团队表示。
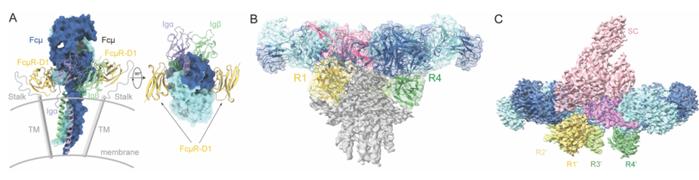
而IgM五聚体与FcμR的4:1复合体结构被解析出来的那一刻,让课题组至今难忘。FcμR的D1结构域与pIgR的D1结构域同源,均负责与IgM的相互作用。因而在课题开始之初,他们预测FcμR会以类似于pIgR的方式结合于R1位点。
然而,在冷冻电镜数据处理过程中,随着三维分类的逐渐深入,他们发现了4:1结合模式的复合体,这一发现令他们既意外又惊喜。
“我们停下手中的工作,不停地讨论着这一意外发现的意义:它到底说明了什么,我们能继续做些什么。”肖俊宇说。
后来,随着结构解析的深入,他们在4:1结合模式的4个复合体FcμR中间发现了一团额外的密度,这团密度可能属于FcμR的stalk区域。
尽管这团密度由于质量较差而无法model,但是这种结合模式和这团密度的存在提示他们:IgM五聚体可能通过诱导FcμR四聚体的形成起始下游信号,stalk区可能进一步介导4个FcμR分子之间的相互作用,促进其结合于IgM五聚体的同一侧。
SIgM与FcμR复合体结构解析出来的时候,同样令人难忘。在该结构被解析出来之前,他们预测在SIgM中由于pIgR占据了R1位点,所以FcμR将会结合于R2-R4位点。
然而,让该团队意想不到的是,在解析出来的SIgM与FcμR的复合体结构中,4个FcμR整整齐齐地排列在IgM的另外一侧,并结合在镜像对称的R1’-R4’位点。
仔细想来,这一结合模式虽在意料之外,却又在情理之中。pIgR的“个头”较大,当它结合于R1位点时,在空间上对R2位点有一定的“遮挡”作用,这阻碍了该位点上FcμR的结合,从而促使FcμR结合于IgM的另外一侧。
而这一结果与他们在晶体结构中的发现一致:即IgM的两个Cμ4结构域对FcμR具有相同的结合能力。
肖俊宇说:“这两个难忘的时刻均缘于实验发现与我们的预期不相一致,但也许这正是科学研究的魅力所在。生命机器的设计复杂而精巧,科学研究就是用多样的技术手段,在不同尺度上探索生命的奥秘,理解生命活动的基础和原理。”
在投稿过程中,论文累计经过3次修改。其中,前2次均需要补充实验。每次时间都很紧张,由于新冠疫情的影响,工作开展更是异常艰难。
第一次补实验的时候,多数时间学校都处于封校状态,试剂订购、仪器平台使用等都受到很多限制。第二次补实验的时候,则正好处于北京疫情高峰期,团队成员一个接一个地“阳”,非常让人心塞。
“但是,大家齐心协力、密切配合,最终圆满回答了审稿人提出的问题。在此,也衷心感谢学校和学院其他老师在试剂盒仪器上给予的帮助。”肖俊宇说。
参考资料:
1.Li,Y.,Shen,H.,Zhang,R.etal. ImmunoglobulinMperceptionbyFcμR. Nature 615,907–912(2023).https://doi.org/10.1038/s41586-023-05835-w
排版:罗以
