解析R848结合流感疫苗的偶联剂依赖效应:对APC激活及体内免疫原性,存在哪些影响?
转自:药时空
灭活疫苗和亚单位疫苗是应对微生物病原体流行的疫苗策略,因为它们通常具有较高的安全性。然而,与活疫苗/减毒疫苗相比,灭活疫苗的免疫原性较低,需要多个增强剂和/或佐剂来激发保护性免疫反应。面对这一挑战,解决方案之一是利用先天免疫受体的佐剂来引发信号,以塑造期望的免疫反应。因此,对于佐剂及其改善灭活疫苗反应的机制进行研究对于制定有效的疫苗策略至关重要。
类似Toll样受体(TLR)激动剂这样的佐剂具有高度免疫调节特性,可以增强疫苗的免疫原性。这些激动剂作用于模式识别受体(PRRs)家族中的TLRs,这些受体广泛分布于先天性和获得性免疫细胞以及其他非免疫细胞上。TLRs的参与促进了微生物感染后的细胞强大激活和成熟,这在产生适当的免疫反应中起着关键作用。
TLRs是一类在细胞表面或内吞体内表达的受体,能识别病毒感染过程中的核酸结构。TLR7/8激动剂能刺激抗原提呈细胞(APC),促进免疫反应,提高疫苗效果。有研究表明,在新生儿APC中使用TLR7/8激动剂可上调共刺激分子和TH1极化细胞因子。另外,对老年个体进行的试验也显示,使用TLR7激动剂作为疫苗佐剂可提高血清转化率。因此,TLR7/8激动剂被认为是一种有效的疫苗佐剂,即使在免疫系统反应较弱的患者中也适用。
需要注意的是,TLR7/8佐剂在疫苗配方中的使用方式对于产生安全有效的疫苗诱导反应非常关键。早期研究表明,静脉或口服给予TLR7/8激动剂可能导致过度免疫反应。为了克服这一问题,已经采用了替代的疫苗配方,通过将佐剂保持在注射部位,将全身毒性降至最低。这些方法包括脂质化、包埋于纳米颗粒中、吸附到明矾上,或直接与蛋白质抗原或聚合物结合。
Seder及其团队证明了“使用TLR7/8激动剂的自聚集结合配方可以改善疫苗反应”,还发现“使用包含血凝素和绑在纳米颗粒上的TLR7/8激动剂的偶联聚合物纳米颗粒水凝胶系统可以提高抗体应答的幅度和持续时间”。通过将TLR7/8激动剂与流感病毒直接偶联,可以进一步增强疫苗的免疫刺激能力。这些研究结果表明,直接连接TLR激动剂和抗原,可以改善疫苗诱导的免疫反应。
Vaccines期刊近期登载的一项研究,着重讨论了偶联剂选择的改进如何影响这些灭活的IAV疫苗的刺激活性,促进了相关领域对体内分化的人APC的影响的了解。此外,研究人员还探索了这些疫苗在体内诱导反应的能力。

doi:10.3390/vaccines11071261.
#材料和方法
1.疫苗构建的准备
在37°C、5%二氧化碳的条件下,通过连接R848的衍生物和偶联剂将R848偶联到接头上。随后,在37°C、5%CO2的条件下,将R848-接头构建体与纯化的IAVA/puertoRico/8/1934(PR8)株孵育,使其与PR8上的游离硫醇偶联,并通过透析去除未结合的病毒和R848。最后,使用甲醛灭活构建物,并进行浓缩和功能评估。
2.人moDC的分化
使用密度梯度离心法从男性和女性献血者的外周血中分离出单个核细胞。通过阳性选择,分离出CD14+细胞。将107个CD14+细胞培养在含有特定培养液的环境中,经过6天的培养,CD11c+细胞达到95%以上。
3.疫苗刺激的moDC用于细胞内细胞因子产生的动力学评估
第6天,人类单核细胞(moDC)在48孔板中培养过夜。使用RPMI培养基,添加10%胎牛血清、2mML-谷氨酰胺、100U/mL青霉素、100µg/mL链霉素、0.05mMβ-ME、10ng/mL人巨噬细胞集落刺激因子和10ng/mL人IL-4。进行单独刺激实验,使用10µg/mLIPR8、IPR8SM(PEG)4-R848、IPR8-GMBS-R848和10µMR848。使用BrefeldinA和莫能菌素,在12-24小时内测定细胞因子的产生。进行细胞染色和流式细胞术分析。
4.分光光度法测R848与PR8灭活疫苗的结合量
通过测定R848在316nm处的消光系数,研究人员使用分光光度计测量了每种疫苗的吸光度。将疫苗构建体校正为IPR8后,研究人员确定了疫苗构建体到IPR8的吸光度变化。最后,研究人员将吸光度的变化除以R848的消光系数。
5.动态光散射以评估疫苗构建体的聚集性
疫苗样品以100微克/毫升的浓度制备,以5900×g的速度离心5分钟,以去除任何灰尘。样品(100微米L)放置在试管中,在配备633nm激光的ZetaSizerNanoZ6(英国伍斯特郡马尔文PANalytical)上运行。在25◦C±0.1◦C下对每次样品运行进行总共10次测量。使用ZetaSizer软件自动确定累积Z平均值和多分散度指数
6.疫苗刺激的人TLR7HEK细胞产生IL-8的评估
293XLhTLR7细胞和HEK-BlueNull1细胞在特定培养条件下进行实验。使用不同剂量的IPR8、IPR8-SM(PEG)4-R848或IPR8-GMBS-R848刺激细胞24小时。收集上清液并测定IL-8的产生。通过与阳性对照R848刺激细胞的最大IL-8浓度进行归一化,确定细胞的相对IL-8产量。这种归一化方法用于分析每种疫苗的IL-8反应。
7.SDS-PAGE和免疫印迹分析
第6天在48孔板中过夜培养人MODC细胞;第7天刺激细胞45、90、135或180分钟。用含有蛋白酶抑制剂的RIPA缓冲液裂解细胞, 使用BCA蛋白分析试剂盒评估蛋白质浓度,用凝胶电泳法分离蛋白质样品,将蛋白质转移到PVDF膜上,在4℃下与药物一起孵育过夜。洗涤膜与抗体结合,使用ECLWesternblotting底物检测蛋白质,清洗膜并添加额外的抗体。
用ImageJ定量测量蛋白质条带的像素密度,最终计算并报告比率。
8.疫苗刺激的PBMCs用于评估细胞内细胞因子的产生
在PBMC(外周血单个核细胞)培养中的实验条件和处理方式,以及对免疫群体进行的表面分析和细胞因子产生的检测方法具体步骤如下:
将PBMC(1个-2×106个/孔)保存在48孔板中,添加不同物质(如L-谷氨酰胺、丙酮酸钠、非必需氨基酸等)和胎牛血清进行培养。使用不同的刺激物(如IPR8、IPR8-SM(PEG)4-R848、IPR8-GMBS-R848、TLR鸡尾酒)刺激PBMC16小时,或不刺激。
对免疫群体进行表面分析,使用特定抗体进行染色(如CD3、CD20、人类白细胞抗原-DR、CD14、CD11c)。在BrefeldinA存在下,检测免疫群体细胞内细胞因子的产生,使用特定试剂盒进行定量,并染色肿瘤坏死因子CD25。使用流式细胞仪采集样品,并使用相应软件进行分析,随后对肿瘤坏死因子α和IL-12p70进行酶联免疫吸附试验。
9.为小鼠接种疫苗
在3周龄BALB/c小鼠肌肉注射IPR8、IPR8-SM(PEG)4-R848或IPR8-GMBS-R848。免疫后14天分离小鼠血清(P.V.)。并检测PR8特异性免疫球蛋白抗体。用6周龄幼稚的BALB/c小鼠血清作为未接种的阴性对照,与接种后14天的动物年龄相近。
10.PR8特异性抗体的酶联免疫吸附试验
将8.4gNaHCO3、3.56gNa2CO3加入去离子水至1.0L,调节pH至9.5,进行0.2mm过滤,准备好缓冲液,在4℃下将纯化的A/putoRico/8/1934(PR8)用上述缓冲液包被过夜。
使用1×封闭缓冲液封闭1小时,然后洗涤,连续稀释血清样品在1倍阻断缓冲液中。使用辣根过氧化物酶(HRP)偶联的小鼠免疫球蛋白抗体(NA931V)检测PR8特异性抗体。使用3,30,5,50-四甲基联苯胺二盐酸盐(TMB)作为底物,并在450nm波长下使用Elx800吸光度微板阅读器读取吸光度。
通过减去非病毒涂层井的OD值来确定每个稀释液中的病毒涂层井的OD值,对只接受1倍封闭缓冲液的PR8涂层孔取平均值来确定检测本底,将吸光度3倍以上的本底定义为阈值滴度(TT)。
11.统计分析
使用Prism9.2.0(GraphPad,LaJolla,CA,USA)进行统计分析,结果以平均值或±SEM表示。进行后自发性Tukey‘s或Fisher’sLSD多重比较分析。P值定义为*p=<0.005,**p=<0.001,*p=<0.0001)。
#研究结果
1.与含SM(PEG)4的疫苗相比,含GMBS的疫苗可促进促炎细胞因子的产生达到更高水平,并使人moDC的比例增加
研究中使用了一种新的策略,通过异双功能偶联剂将TLR7/8激动剂R848与IAV偶联。研究发现偶联剂的选择会影响R848-疫苗结合物对细胞的刺激效果。此外,研究还探讨了细胞因子产生的增加是由于每个细胞产量的增加还是细胞数量的增加,或者两者兼而有之。研究使用了CD14+PBMC分化为moDC,并通过细胞内细胞因子染色法检测细胞因子的产生。
在两个时间点上,IPR8-GMBS-R848刺激的细胞中,肿瘤坏死因子α+细胞的比例均高于IPR8-SM(聚乙二醇4-R848)刺激的细胞(图1A,C)。与IPR8-SM(聚乙二醇4-R848)刺激的细胞相比,刺激后12小时观察到更高比例的细胞(图1A),与每个细胞上更高的肿瘤坏死因子α表达有关(图1B)。
接下来,研究人员评估了疫苗刺激的moDC中产生IL-12p70的细胞的比例。研究人员观察到产生IL-12p70的细胞亚群相对较少(图1E,G)。与未检测到IL-12p70的IPR8-SM(α)4-R848刺激的细胞相比,IPR8-GMBS-R848刺激促进了IL-12p70+细胞比例的增加(图1G),并增加了每个细胞中的IL-12p70水平(图1H)。与肿瘤坏死因子α相比,刺激后24小时的反应最强(图1G,H),而刺激后12小时的反应最强(图1E,F)。
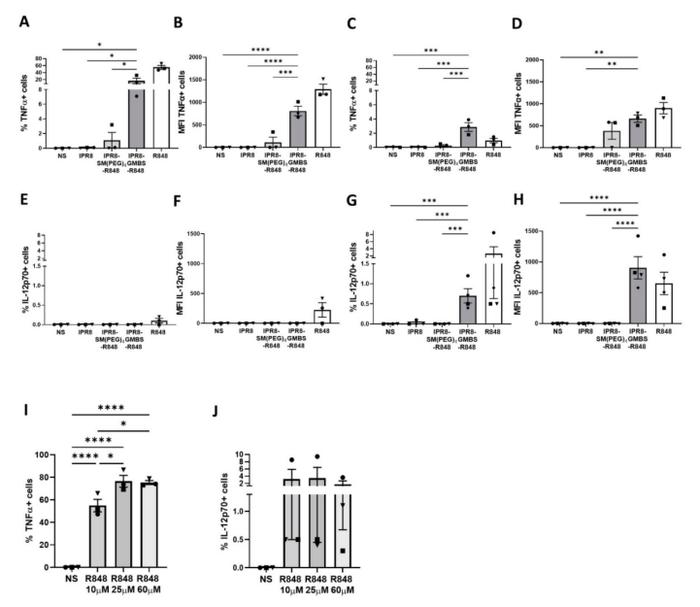
从健康成人供者体内分离CD14+PBMC,加入10ng/mL人IL-4和GM-CSF培养7天。体外用IPR8、IPR8-SM(PEG)4-R848、IPR8GMBS-R848(所有疫苗均为10微克/毫升)、R848(10微克/毫升)或未刺激(NS)刺激人moDC。用流式细胞仪检测细胞内细胞因子的产生。分别于刺激后0~12h(A、B)和12、24h(C、D)检测肿瘤坏死因子α+CD11c+细胞百分率。分别于刺激后0~12h(E、F)和12、24h(G、H)检测IL-−12p70+CD11c+细胞百分率和MFI值。用不同浓度的可溶性R848(10、25、60µM)刺激人MODC,检测肿瘤坏死因子α+CD11c+细胞(I)和IL-−12p70+CD11c+(J)的百分率和MFI值。这些数据代表了3-4个供者的平均值。图表上的符号代表个人捐赠者。所有疫苗刺激(不包括R848)的统计学意义采用单因素方差分析和后Fisher‘sLSD多重比较分析进行评估。*p=<0.005,*p=<0.0005,*p=<0.0001。
研究发现,相比于肿瘤坏死因子α,产生IL-12p70的细胞比例较小。通过使用R848刺激moDC,发现增加刺激并不会导致IL-12p70+细胞的百分比增加(图1I)。这表明,只有一小部分moDC有能力产生IL-12p70来响应R848。
总体而言,与SM连接疫苗相比,GMBS连接疫苗能够提高产生促炎细胞因子的细胞百分比和每个细胞的细胞因子表达。
2.GMBS和SM(PEG)4疫苗构建物具有与灭活病毒粒子结合的相似数量的R848
研究人员接下来探索了不同连接子结构对刺激能力的影响,并评测了R848的浓度测试结果。实验结果表明,不同疫苗中R848的含量相似,而GMBS疫苗结构观察到的刺激活性改善并不是由于病毒粒子上R848数量的增加所致。
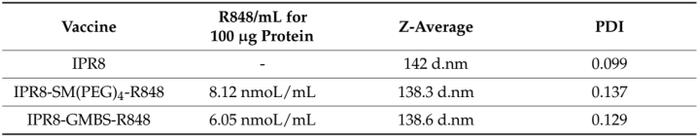
表1.不同疫苗结构的特点
3.差异聚集不能解释用疫苗构建物观察到的刺激活性
早有研究证实,疫苗中的蛋白质聚集体可以增强疫苗的免疫原性。因此,研究人员评估了SM(PEG)4和GMBS链构建的疫苗在聚集能力方面是否有所不同。
研究人员使用动态光散射(DLS)对每种疫苗中颗粒的大小和均匀性进行了定量分析。测量了每种疫苗的颗粒大小分布和多分散指数(PDI)(图2)。Z-Average通过DLS测量一组颗粒的强度加权平均水动力尺寸。当研究人员将IPR8-SM(聚乙二醇4-R848)(Z-Average=138.3d.nm)与IPR8-GMBS-R848(Z-Average=138.6d.nm)进行比较时,研究人员观察到类似的Z-Average(表1)。
每种疫苗都呈现出单峰分布,两种佐剂疫苗的强度相似(图2)。PDI用于衡量样品中的异质性,即聚集性。研究人员观察到,与IPR8相比,两种连锁疫苗的PDI略有增加(图2);然而,两种连锁疫苗的PDI(IPR8-SM(聚乙二醇)4-R848,PDI=0.137和IPR8-GMBS-R848,PDI=0.129)相似。因此,这些数据表明,接头的选择不会对佐剂疫苗的一致性产生影响,这表明GMBS疫苗观察到的增强刺激能力不是由于聚集性的改变所致。
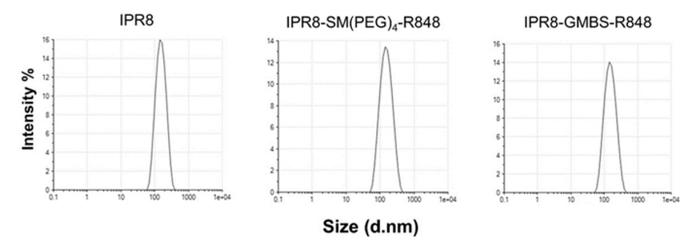
对IPR8、IPR8-SM(PEG)4-R848和IPR8-GMBS-R848进行动态光散射以评估均匀性
4.依赖连接子的刺激活性差异依赖于TLR7/8的参与
通过实验证明,接头的选择可以改变小鼠RAW264.7巨噬细胞和人moDC的刺激活性。这与R848结合疫苗通过TLR7(RAW264.7)以及TLR8(MoDC)激活的能力一致(图3)。虽然结合TLR7/8可能是解释两种疫苗反应变化的最有可能的方式,但连接子的存在可能会影响疫苗与其他途径的结合方式。为了进一步测试,研究人员使用转TLR7的人293XLHEK细胞株进行了实验,结果表明IPR8-GMBS-R848疫苗的刺激活性增加是通过与TLR7/8结合介导的。
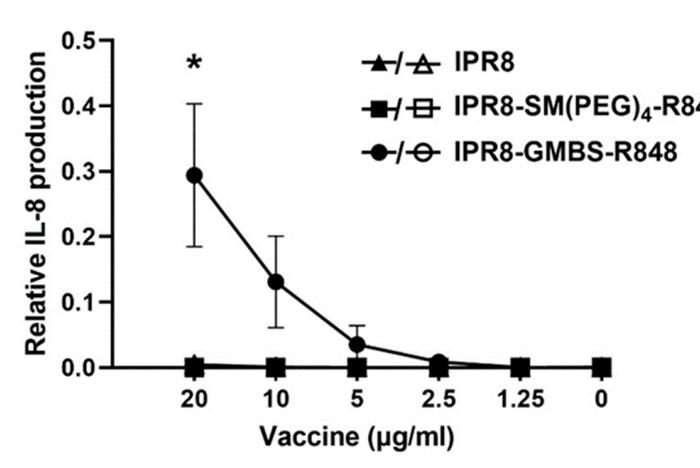
用IPR8、IPR8-SM(聚乙二醇)4-R848、IPR8-GMBS-R848(20μg/ml~1.25μg/mL)和R848(10µM~0.078µM)体外刺激HEKXL-293hTLR7细胞,或不刺激(NS)。刺激后24h取上清液,用双抗体夹心法测定IL-8的产生。为了评估TLR7非依赖IL-8产生的可能性,HEK-BlueNull1细胞被类似地刺激(开放符号)。通过将每个疫苗剂量的IL-8浓度(pg/mL)与阳性对照R848刺激细胞产生的IL-8的最大浓度(pg/mL)进行归一化来确定IL-8的相对量。这些数据代表来自n=3(hTLR7HEK细胞)和n=2(Null1细胞)的平均值。每个实验重复(N)在不同的天数和不同的细胞传代中独立进行。采用单因素方差分析和后Tukey多重比较分析。20µg/mLIPR8-GMBS-R848刺激的细胞与IPR8或IPR8-SM(PEG)4-R848刺激的细胞相比有统计学意义(*p=<0.05)。
5.与IPR8-SM(κ)4-R848相比,IPR8-GMBS-R848促进I-αB磷酸化增加
研究人员假设观察到的这些疫苗刺激活性的差异是由于不同的TLR信号所致。由于人类moDC优先对TLR8激动剂产生反应,研究人员预计疫苗将通过这些细胞中的TLR8/MyD88通路发出信号。TLR8信号激活多种转录因子,包括核因子-κB,从而产生促炎细胞因子。因此,研究人员评估了疫苗构建中观察到的细胞因子产生差异与不同NF-κB活化之间的关联。
在静息状态下,核因子-κB通过核因子-κB(I-κB)家族成员的抑制物被隔离在细胞质中,该家族成员掩盖了对核转位至关重要的信号。在细胞受到刺激后,IκBα被IκB激酶(IKK)磷酸化,导致泛素介导的IκBα降解,进而允许核因子-κB亚单位的核转位和促炎细胞因子基因的转录。
为了评估NF-κB的活性,研究人员测量了疫苗刺激的人MODC中IκBα的磷酸化和总IκBα随时间(45、90、135和180min)的变化(图4A)。
实验方法:
使用人类MODC细胞,测量疫苗刺激后IκBα磷酸化和总IκBα的变化。
选择刺激后135分钟的时间点,计算磷酸化IκBα/总IκBα的比值。
实验结果:
-IPR8-GMBS-R848疫苗刺激的细胞中磷酸化IκBα/总IκBα比率显著增加,与其他疫苗相比。
-不同疫苗刺激组的总IκBα水平相似,支持在IPR8-GMBS-R848刺激的MODC中NF-κB的激活增加。
综上所述, 在IPR8-GMBS-R848刺激的MODC中观察到促炎细胞因子的产生增加,说明该疫苗可能具有增强免疫反应的潜力。
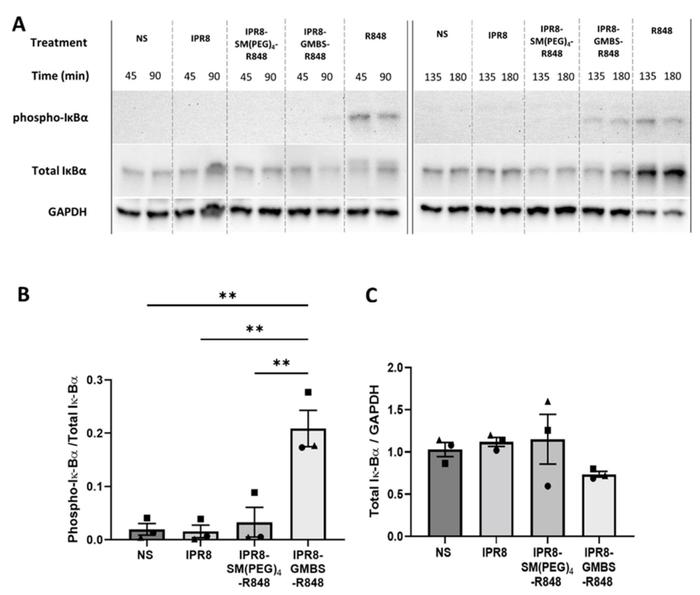
从健康成人供者体内分离CD14+PBMC,加入10ng/mL人IL-4和GM-CSF培养7天。用10μg/mLIPR8、IPR8-SM(聚乙二醇)4-R848、IPR8-GMBS-R848、R848单独刺激或不刺激(NS)45、90、135或180分钟。细胞裂解物(12.5SDSg)在10%μ-PAGE凝胶上运行。免疫印迹法检测磷酸化IκBα和总IκBα。GAPDH作为加载对照。(A)Blot是三个独立实验的代表。135min的免疫印迹结果被量化并报告为磷酸化IκBα/总IκBα(B)或总IκBα/GAPDHC(C)。统计分析采用单因素方差分析和后Tukey多重比较分析。这些数据代表了3个供体的平均值。图表上的符号代表个人捐赠者。**p=<0.005。
6.GMBS疫苗构建促进PBMCs内APC产生促炎细胞因子
人MODC模型可用于研究APC体外分化机制,但与体内分化的细胞相比,它们的反应可能有所不同。研究发现,使用GMBS结合疫苗刺激体内分化的细胞更具刺激性,并且可以研究DC以外的其他细胞类型。
IPR8-GMB-R848疫苗刺激的细胞可显著增加肿瘤坏死因子α和IL-12p70的产生。此外,疫苗刺激并未显著增加干扰素α的产生。这些结果表明,GMBS相关疫苗在体外可促进人外周血单核细胞产生更多的促炎细胞因子(图5)。
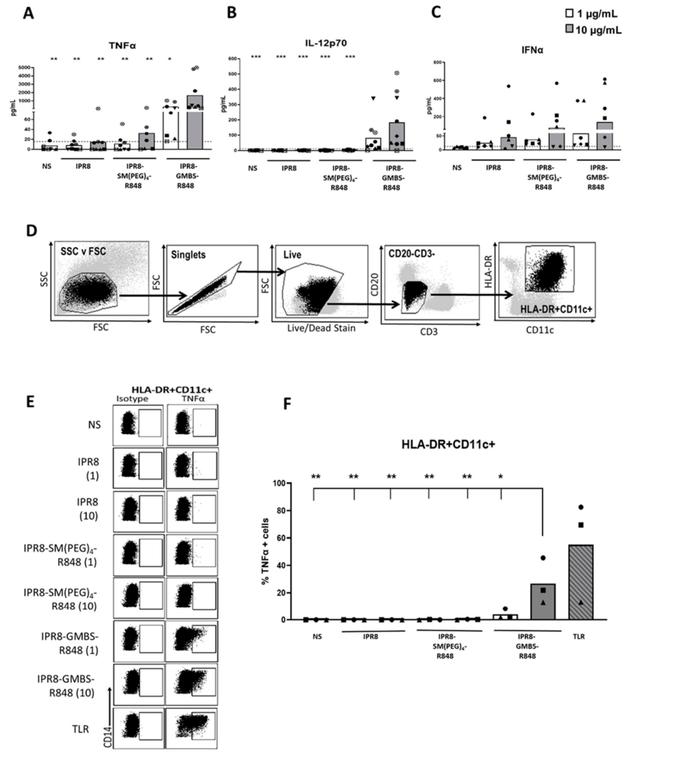
图5.与单独用IPR8-SM或IPR8刺激相比,IPR8-GMBS-R848刺激PBMC内的抗原提呈细胞产生更多的肿瘤坏死因子α
分离健康成人供者的PBMC,用IPR8、IPR8-SM(聚乙二醇)4-R848、IPR8-GMBS-R848(1μg/mL和10μg/mL)刺激PBMC,或不刺激(NS)。刺激后24h取上清液,用双抗体夹心酶联免疫吸附试验检测肿瘤坏死因子α、白介素12p70和干扰素α的产生。从健康成人供体分离PBMC,分别用IPR8、IPR8-SM(聚乙二醇)4-R848、IPR8-GMBS-R848(所有疫苗均为1μg/mL和10μg/mL)、阳性对照的TLR鸡尾酒(MPLA1μg/mL、PolyI:C1μg/mL和R84810μM)体外刺激或不刺激(NS)16h,加入BrefeldinA,最长12h(存在于刺激4~16h)。刺激后,收集细胞并进行标记表达和细胞因子产生的染色。(D)APC为CD3-CD20-HLA-DR+CD11c+的活细胞。(E)肿瘤坏死因子α产生APC的典型流程图(HLADR+CD11c+)。(F)肿瘤坏死因子α+细胞百分比(HLADR+CD11c+)。数据代表6-9个供体的平均值和3个供体用于流式细胞仪分析的平均值。图表上的符号代表个人捐赠者。所有疫苗刺激(不包括TLR混合)的统计学意义用单因素方差分析将每个疫苗刺激的平均值与所有其他疫苗刺激的平均值进行比较,并进行后Tukey多重比较分析。只有IPR8-GMBS-R848在10μg/mLIPR8-GMBS-R848组与其他刺激组(不包括TLR混合物)相比有统计学意义。*p=<0.005,*p=<0.0005。
经过IPR8-GMBS-R848刺激16小时,肿瘤坏死因子α产生的HLADR+CD11c+细胞的百分比显著增加(图5e,F)。研究人员还评估了16-20小时后不同疫苗刺激的PBMC中产生IL-12p70的细胞的百分比;然而,即使使用可溶性R848也很难检测到相应的反应(数据未显示)。在大量PBMC培养中检测到了显著但较低数量的IL-12p70,以及少量的IL-12p70+moDC(图1D,左图),这使研究人员得出结论,产生IL-12p70的细胞数量低于通过流式细胞仪检测到的极限。
在流式细胞仪分析中,观察到CD14在人类白细胞抗原-DR+CD11c+细胞中的表达与肿瘤坏死因子α产生相关。CD14是一种能区分树突状细胞中的单核细胞的通用标记物。研究发现,CD14在这个细胞群中的表达与疫苗的刺激活性有关,随着刺激能力和疫苗剂量的增加,CD14的表达也增加。
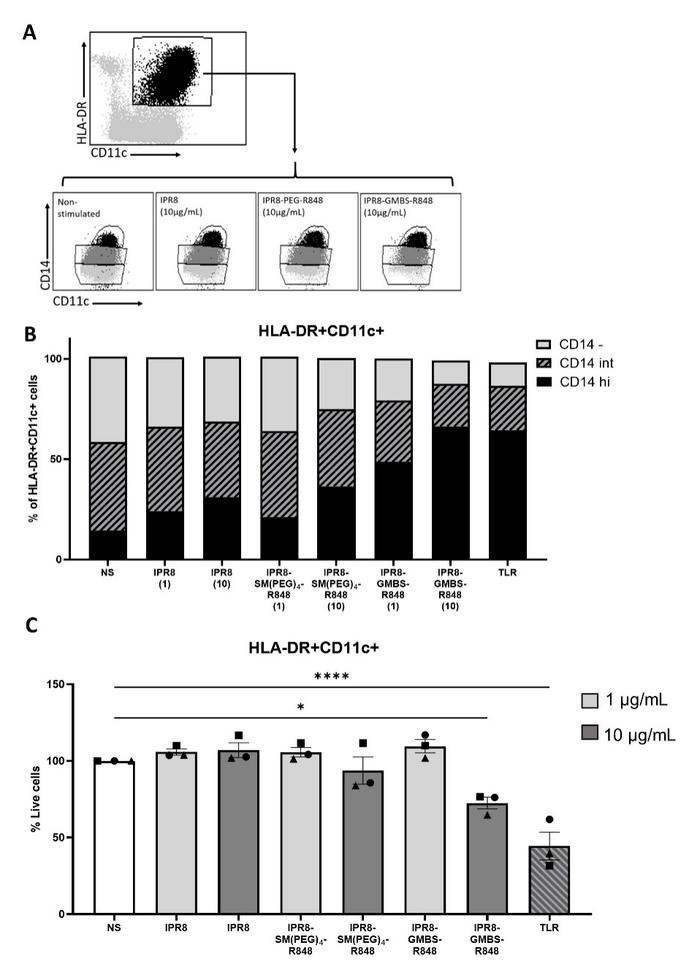
分别用IPR8、IPR8SM(聚乙二醇)4-R848、IPR8-GMBS-R848(1μg/mL和10μg/mL)刺激PBMC,并以TLR1μg/mL、PolyI:C1μg/mL和R84810μM为阳性对照,不刺激(NS)16h。(B)CD14高(高)、CD14中等(INT)或CD14阴性(-)的人类白细胞抗原-DR+CD11c+细胞的百分比。(C)对活细胞群体中人类白细胞抗原-DR+CD11c+细胞的百分比进行量化。数据为3个供体的平均扫描电子显微镜。图表上的符号代表个人捐赠者。统计学意义采用单因素方差分析和后Tukey的多重比较分析。*p=<0.0001,*。
尽管研究人员确实观察到高剂量的IPR8-GMBS-R848和TLR鸡尾酒刺激组中有中等水平的细胞死亡,但CD14表达的变化不能完全归因于这一点。在IPR8-GMBS-R848刺激的细胞中,即使在不增加细胞死亡的条件下,观察到1微克/毫升刺激细胞中CD14表达APC的比例增加(图6C)。这些数据支持了一种模型,即刺激正在推动人类白细胞抗原DR+CD11c+细胞上CD14表达的增加。
7.与SM(PEG)4结合疫苗和IPR8疫苗相比,GMBS结合疫苗促进PR8特异性抗体的增加
基于研究人员发现IPR8-GMBS-R848疫苗在体外和体内培养的细胞中刺激活性增加的结果,研究人员进一步评估了其在体内是否表现出更强的活性。研究人员认为这是有可能的,因为研究表明来自抗原呈递细胞的细胞因子可以影响T辅助细胞的激活和分化,而T辅助细胞的活性则指导着体液免疫反应的规模和特性。
流感疫苗对婴儿健康至关重要,一般从6个月开始接种。研究使用小鼠模型发现,使用GMBS接头的R848接合疫苗可以显著增强体内PR8特异性免疫球蛋白水平(图7),表明这种疫苗具有更强的刺激活性。
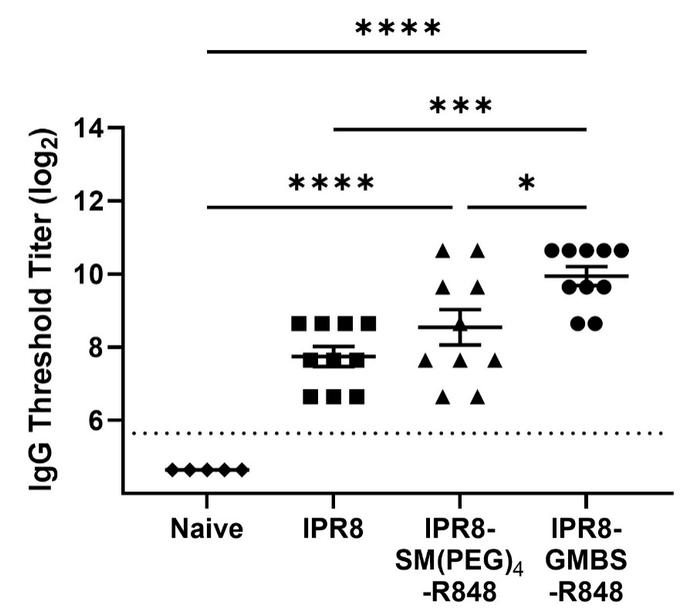
BALB/c小鼠(n=10)肌肉注射疫苗。含0.03微克IPR8、IPR8-SM(PEG)4-R848或IPR8-GMBS-R848。静脉注射14天后采血。以幼稚BALB/c小鼠(n=5)血清为阴性对照。用酶联免疫吸附试验检测血清中PR8特异性总免疫球蛋白的水平。阈值滴度(TT)被定义为样品的光密度至少是检测背景的3倍时的最高稀释度。探测极限用虚线表示。数据代表了在两个独立的实验中接种疫苗的小鼠的平均值。图表上的符号代表不同的疫苗组。统计学意义采用单因素方差分析和多因素比较分析*p=<0.0005,*p=<0.0001。
#讨论与分析
尽管疫苗取得了巨大的成功,但显然有必要提高现有方法的有效性,尤其是在免疫系统反应较弱的人群中,以产生最佳的免疫反应。因此,人们开始关注确定可以增强疫苗刺激力的佐剂。在研究人员之前的研究中,研究人员发现TLR7/8激动剂R848与流感病毒颗粒的结合,无论是体外还是体内,都比单独的病毒颗粒具有更强的免疫刺激活性。随后,研究人员发现用于连接的结合剂会影响刺激体外分化的树突状细胞的能力。在本研究中,研究人员进一步拓展了这一发现,证明了GMBS结合疫苗能够增加产生细胞因子的moDC的比例,并使每个细胞产生更多的细胞因子。这些发现得到了体内分化真正的抗原呈递细胞的结果的支持。刺激活性的增加与NF-κB通路的激活程度增加有关。最重要的是,研究人员证明了刺激活性的增强转化为接种疫苗后抗体反应的改善。
研究人员对于IPR8-GMBS-R848疫苗如何产生这种效果感到非常感兴趣。研究人员之前认为,疫苗与moDC的关联类似,而这项研究则证明了这并不是R848共轭或聚集增加的结果。后者非常引人关注,因为先前的研究已经发现,约20-200nm大小的病毒颗粒对树突状细胞的摄取能力影响最佳。此外,Seder及其同事的卓越研究显示,TLR7/8激动剂偶联的合成聚合物的大小对树突状细胞和单核细胞的摄取和成熟产生了深远的影响。
尽管研究人员没有观察到细胞结合、R848结合或大小方面的明显变化,但研究人员确实发现,GMBS和SM(PEG)4结合疫苗在TLR信号传导方面存在显著差异。GMBS疫苗促进了NF-κB活性的增加,表现为IκBα的磷酸化增加。研究人员最初假设TLR8信号的变化可能是定性的,也可能是定量的。
在GMBS疫苗刺激的细胞中,核因子-κB活性的增加以及肿瘤坏死因子α和IL-12p70的产生增加,表明GMBS与SM(PEG)4疫苗构建物的数量效应至少是这一现象的部分原因。这种差异可能是如何发生的呢?TLR7和TLR8以同源二聚体的形式存在于内体中,在与单链RNA结合之前需要蛋白水解性切割。研究人员推测,R848的释放可能受到内体隔室中水解酶的影响。由于使用的连接物不同,R848的释放可能对这一过程的敏感性有所不同,从而可能改变TLR结合的有效性。对于TLR信号变化的另一个假设是,其部分是由于疫苗的内化和/或转运到内体的增加。进一步的研究将有助于探索这些可能性。
在研究人员的外周血单个核细胞研究中,一个有趣的发现是,在刺激后,CD11c+细胞上的CD14表达上调。也就是说,表达CD14的细胞的百分比与细胞因子产生的程度密切相关。以前的研究已经报道,在IL-1β存在的情况下,该分子在树突状细胞上上调。
研究人员的研究中观察到的上调与研究人员之前对moDC的分析一致,研究人员发现IPR8-GMBS-R848刺激后产生的IL-1β水平明显高于IPR8-SM(PEG)4-R848。尽管树突状细胞被认为是激活初始T细胞反应的关键细胞类型,但有证据支持单核细胞通过抗原递呈和细胞因子产生的作用。在人源化的小鼠模型中,已发现CD14+树突状细胞在驱动CD4+T细胞向TH1分化途径偏倚方面起着重要作用。IPR8-GMBS-R848促进IL-12p70的产生,表明激活的APC能够驱动TH1的偏倚。
研究人员先前的研究表明,与无佐剂的IPR8疫苗接种相比,接种IPR8-SM(聚乙二醇4-R848)疫苗可提高新生儿AGM的免疫原性。有趣的是,与在没有佐剂的情况下接种IPR8的动物相比,研究人员在接种IPR8-SM(聚乙二醇4-R848)后24小时引流的淋巴结中未观察到新生树突状细胞上共刺激分子的增加。
最近的研究发现,GMBS偶联剂在RAW264.7细胞、人MODC和PBMC中更有效地诱导APC成熟和促炎细胞因子的产生,这表明该构建物在体内可能具有更高的活性。研究人员的最新发现证实了这一点,表明在接种的小鼠中,GMBS连锁疫苗产生比IPR8-SM(聚乙二醇4-R848)链接疫苗或IPR8疫苗更高水平的流感病毒特异性免疫球蛋白。
研究发现,通过使用GMBS偶联剂,可以提高婴儿中IPR8-R848疫苗的接种效果。这可能是在促进抗原呈递细胞的成熟和促炎细胞因子的产生的过程中实现的。这项研究为改进疫苗的佐剂研究提供了新的见解,并支持进一步研究这一方法的必要性。
参考文献:CroftsKF,PageCL,SwedikSM,HolbrookBC,MeyersAK,ZhuX,ParsonageD,WestcottMM,Alexander-MillerMA.AnAnalysisofLinker-DependentEffectsontheAPCActivationandInVivoImmunogenicityofanR848-ConjugatedInfluenzaVaccine.Vaccines(Basel).2023Jul20;11(7):1261.doi:10.3390/vaccines11071261.PMID:37515076;PMCID:PMC10383912.
