不同HER2蛋白表达水平的HER2阳性乳腺癌,对HER2靶向治疗的反应存在差异
转自:医学界
越来越多的数据表明,HER2阳性乳腺癌受HER2蛋白表达水平、HER2基因拷贝数水平、ER状态等多种因素影响,对HER2靶向治疗表现出不同的应答反应。近期,在线发表于BritishJournalofCancer 的一项研究利用大型乳腺癌队列(n=7390),评估HER2不同免疫组化亚型(IHC3+和IHC2+/ISH+)的临床病理特征和基因表达差异(DGE),并探索HER2表达水平与新辅助/辅助治疗的病理学完全缓解(pCR)率和生存结局的相关性,以及雌激素受体(ER)状态在其中发挥的作用[1]。研究结果显示,HER2阳性乳腺癌中HER2蛋白过表达是致癌通路的驱动因素,也是对抗HER2治疗产生响应的主要预测因子。相比HER2IHC3+人群,ER信号通路的影响在IHC2+乳腺癌中更为显著。提示应考虑基于IHC检测结果实施个体化抗HER2治疗,从而为患者提供更大化的获益。本文撷取该研究重要内容整理如下,以供参考。
研究方法
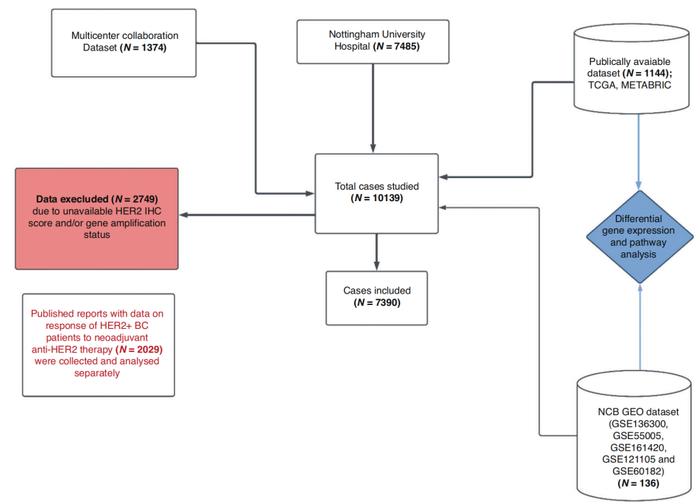
本研究最初共纳入10,139例侵袭性乳腺癌病例,包括三大队列:
第一队列为诺丁汉大学医院(NUH)的乳腺癌患者(n=7485)。
第二队列来自公开可用的乳腺癌数据库(PABCD),包括癌症基因组图谱(TCGA)乳腺癌队列(n=855)、国际乳腺癌协会的分子分类数据库(METABRIC,n=289)和基因表达综合(GEO)数据库(n=136)。NUH、TCGA和METABRIC有可用的临床病理数据,包括诊断年龄、肿瘤大小、组织学肿瘤分级、腋窝淋巴结(LN)状态、组织学肿瘤类型、淋巴血管浸润、诺丁汉预后指数(NPI)、HER2IHC评分(0-3)、HER2基因扩增、HR状态[包括雌激素受体(ER)和孕激素受体(PR)],以及长期随访数据。NUH队列提供了辅助治疗方案(化疗和抗HER2治疗)的数据;而TCGA和METABRIC队列通过PAM50分类和IntClust亚型分别提供了内在分子亚型的数据。
第三个队列来自先前发表的关于HER2阳性乳腺癌患者的多中心研究(n=1374)[2]。从该队列中获取有关新辅助治疗、pCR、HER2IHC评分、HER2基因扩增、HER2/CEP17比值、HR状态、核心活检的组织学肿瘤分级和组织学肿瘤类型的数据。该队列中HER2IHC2+/扩增病例的比例较高,可评估新辅助治疗在HER2阳性两种IHC亚型的差异(图1)。
排除没有HER2IHC评分和/或基因扩增状态的病例,最终纳入7390例患者。其中1052例接受了新辅助治疗,751例有pCR数据(图1)。纳入的研究中有六项研究有HER2阳性乳腺癌患者对治疗反应差异的数据,从而评估不同HER2阳性状态对抗HER2治疗的响应情况。通过乳腺癌特定生存(BCSS)和无远处转移生存(DMFS),评估抗HER2辅助治疗后不同HER2蛋白表达水平与结局的相关性。
研究结果
1.人口统计学和病理学特征
在整个队列中,中位HER2基因拷贝数为2.0,中位HER2/CEP17比值为1.5。根据IHC亚型对HER2阳性乳腺癌进行分层时,在IHC3+的患者中,中位HER2基因拷贝数为9.0,中位HER2/CEP17比值为4.0。在IHC2+/扩增的患者中,中位HER2基因拷贝数为4.4,HER2/CEP17比值为2.3。IHC2+的患者中80%为ER阳性,而IHC3+中为60%。
HER2IHC3+与侵袭性肿瘤的生物学行为特征之间存在显著相关性,包括较大的肿瘤大小、较高的肿瘤分级和淋巴结阳性,以及ER和PR阴性(P<0.001)。将IHC3+肿瘤与IHC2+/ISH+进行比较时,这些相关性仍然存在。
与IHC2+/ISH+肿瘤相比,IHC3+与HER2富集(HER2-E)分子亚型有显著相关性(64%vs25%,P<0.001)。相比之下,当考虑HER2基因拷贝数或HER2/CEP17比值时,未发现与HER2E分子亚型相关。此外,当HER2基因扩增水平较高(≥9.0拷贝数)的IHC2+与IHC3+肿瘤比较时,HER2-E分子亚型以及HR-与IHC3+的肿瘤类型仍存在显著相关性(P=0.01、ER:P=0.03、PR:P=0.008)。
2.HER2阳性不同IHC亚型对新辅助治疗的反应差异
总体而言,整个乳腺癌新辅助治疗队列中pCR为26%,HER2阳性为36%。基于不同HER2阳性状态进行分层时,IHC3+肿瘤的pCR显著高于IHC2+/ISH+的肿瘤(57%vs22%,P<0.001)。在HER2阳性肿瘤队列中,HER2基因拷贝数水平低(<9.0)和高(≥9.0)的乳腺癌患者的pCR率没有显著差异(P=0.13);HER2/CEP17比值≥2.0与<4.0或≥4.0的患者间pCR率也没有差异。此外,HER2IHC2+和基因扩增水平高的患者相比HER2IHC3+(无论其基因扩增水平如何)的pCR率更低(17%vs57%,P=0.001)。考虑到整个HER2表达谱系,pCR与HER2/CEP17比值之间存在显著正相关(P=0.0.03),但在IHC2+/ISH+患者中并未观察到这种相关性(P=0.5)。
本研究显示的平均pCR率为46%(与既往发表的研究一致),其中IHC3+和IHC2+/ISH+的平均pCR率分别为56%和23%。HER2阳性患者中,ER阳性与pCR率较低显著相关(pCR率为33%,无反应率为67%);在IHC3+的乳腺癌患者中,ER状态与pCR率之间无显著相关性,而在IHC2+/ISH+的患者中,ER阴性与pCR率增加显著相关(P < 0.001)。在IHC2+/ISH+肿瘤中,接受新辅助化疗的pCR率为13%,而IHC3+的患者pCR率为39%。在接受抗HER2治疗后,IHC3+患者的pCR率增加至57%,而IHC2 + /扩增患者仅为21%。
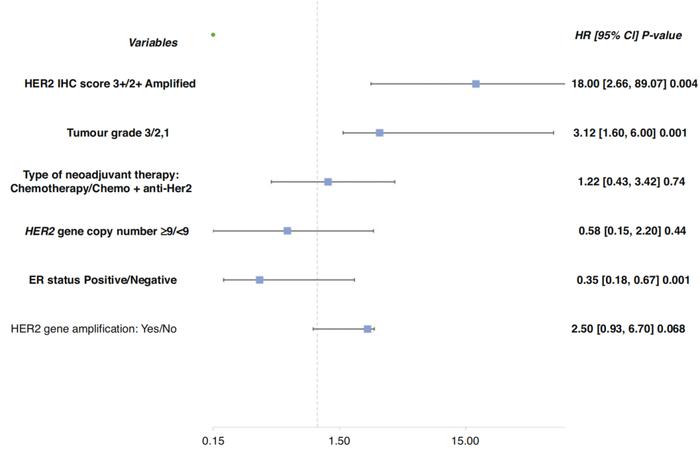
多因素逻辑回归模型显示,IHC3+是pCR的独立预测因子,超过HER2基因扩增水平(OR18.00,P = 0.004)。此外,组织学分级为3级(OR3.12,P = 0.001)和ER阳性(OR0.35,P = 0.001)也是pCR的独立预测因子(图2)。
3.不同HER2阳性组的生存结局
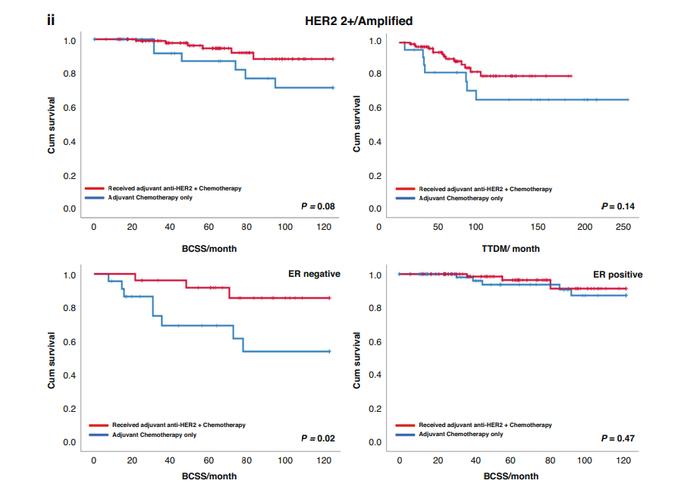
在未接受治疗(未接受抗HER2治疗)患者中,IHC3+组的中位BCSS明显短于IHC2+/ISH+组(84个月vs119个月,P=0.01)。在抗HER2治疗后,IHC3+组的中位BCSS增加到110个月,接近IHC2+/ISH+组(P=0.23)。在IHC3+的乳腺癌患者中,抗HER2辅助治疗联合化疗显著提高10年无疾病生存率(BCSS:P<0.001;DMFS:P=0.006)。然而,在HER2IHC2+/ISH+肿瘤中,未观察到显著差异(BCSS:P=0.08;DMFS:P=0.14)(图3-4)。
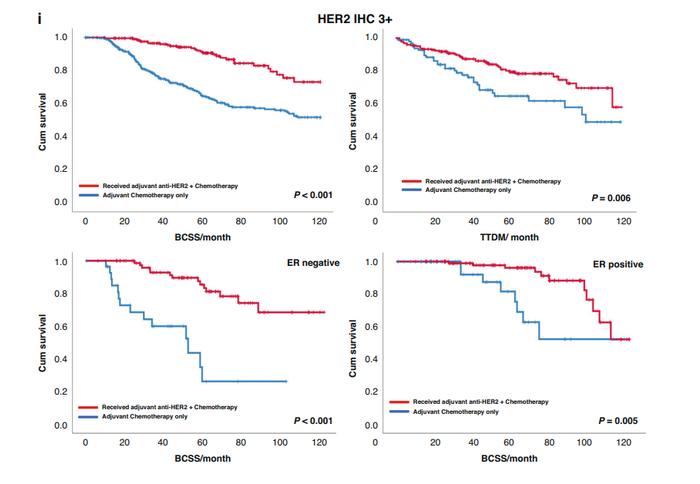
根据ER表达水平进行分层时,IHC2+/ISH+且ER阴性患者接受抗HER2辅助治疗联合化疗的预后有所改善(BCSS:P=0.02)。但在IHC2+/ISH+且ER阳性患者中未观察到类似的结果(BCSS:P=0.47)(图4)。与此相反,IHC3+的患者中,无论ER表达水平如何,均观察到抗HER2治疗与生存期改善的相关性(BCSS:ER阴性:P<0.001,ER阳性:P=0.005)(图3)。
4.HER2阳性IHC亚型的分子特征及其对治疗反应的影响
通过生物信息学分析确定在HER2两个IHC亚型(IHC3+和IHC2+/ISH+)以及IHC2+/ISH-肿瘤中驱动HER2信号通路和对曲妥珠单抗治疗反应的基因。与IHC2+/ISH+肿瘤相比,HER2信号通路基因在IHC3+肿瘤中显著富集(图5),但这些基因的表达差异在两个IHC亚型之间并不显著。
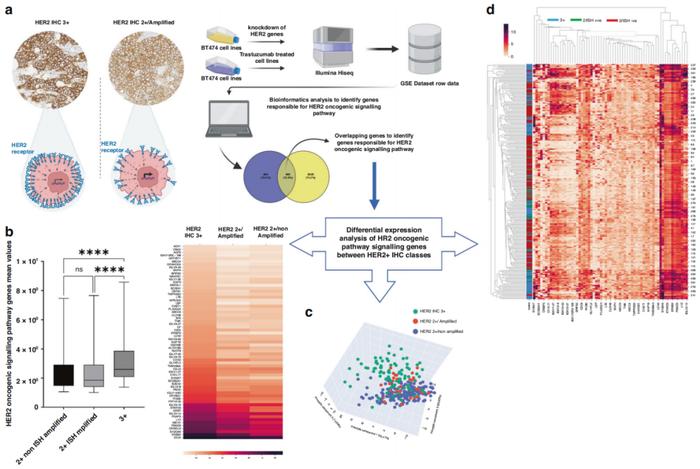
a:从GEO数据集中提取原始数据,进行生物信息学分析以确定负责HER2致癌通路和对治疗发生反应的基因。b:与HER2IHC2+肿瘤相比,IHC3+肿瘤的HER2信号通路基因显著富集,与扩增状态无关。c、d:无监督聚类分析和热图展示了HER2阳性亚型中HER2致癌通路基因的表达情况。
在IHC3+和IHC2+/ISH+组间对曲妥珠单抗治疗耐药基因进行差异分析,发现了82个基因;其中,50个基因在IHC2+/ISH+组中显著上调。通过在线数据库检测这些基因的预测效度,发现12个基因与HER2阳性乳腺癌抗HER2治疗无病理反应显著相关。与IHC3+相比,ER信号通路基因在IHC2+/扩增组中显著富集(P=0.008,图6)。
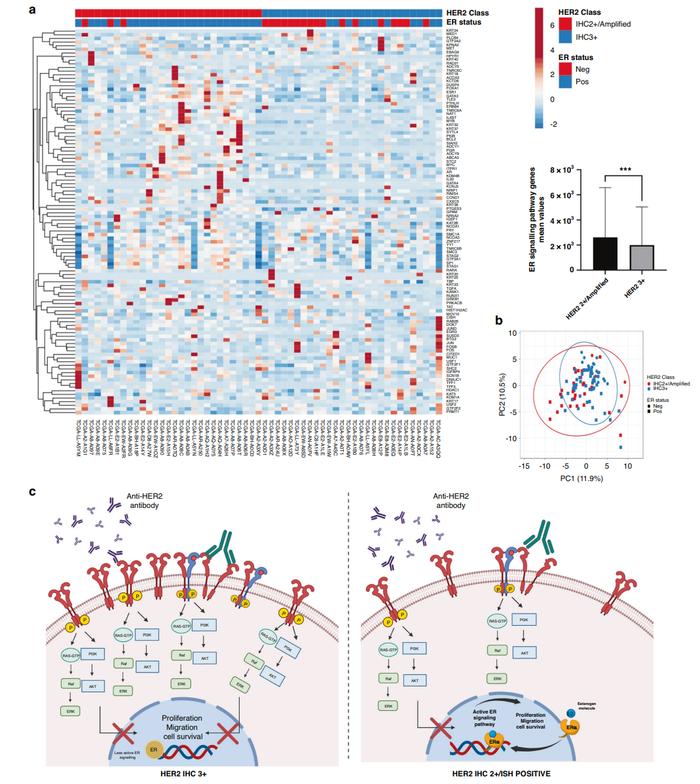
a:热图显示了HER2IHC3+和IHC2+/扩增亚型中ER信号通路基因的无监督聚类和分布,其中在IHC2+/扩增亚型中显著表达(P=0.008)。b:主成分分析(PCA)显示大多数ER阳性肿瘤属于HER22+/扩增亚型。c:可视化图表明了ER阳性在HER2阳性IHC分类中的重要性。HER2IHC3+主要依赖于HER2致癌信号通路,因此抗HER2治疗的有效性取决于阻断该通路(如图左侧所示)。相反,在HER2IHC2+扩增肿瘤中(如图右侧所示),ER信号通路仍然活跃,癌细胞逃避了抗HER2干预的抑制作用,维持其增殖
讨论与思考
HER2阳性乳腺癌患者对HER2靶向治疗的应答,无论是考虑蛋白表达还是基因扩增水平,仍有待确认哪个是关键驱动因素。大多数抗HER2靶向治疗是直接与HER2蛋白产生作用,且在IHC0或1+以及ISH阴性的乳腺癌患者中未观察到明显的治疗应答,而IHC结果和HER2基因拷贝数之间存在高度一致性[3]。HER2IHC3+与HER2基因高水平扩增之间存在高度相关性,这可能解释为什么大多数高扩增水平的病例对HER2靶向治疗反应良好。主要分歧发生在HER2IHC2+肿瘤中,这些肿瘤通常表现为基因扩增水平接近临界值。基于IHC与ISH状态的相关性以及这些IHC亚型的分子特征尚未明确,本研究旨在阐明这些亚型中抗HER2治疗反应以及相关的临床生物学特征和分子机制。
在新辅助治疗中,本研究显示,HER2阳性乳腺癌患者使用抗HER2治疗联合化疗的总pCR率为36%。然而,根据IHC进行分层时,IHC3+患者的pCR率显著高于IHC2+/扩增的患者。当比较所有HER2IHC亚型时,高HER2基因扩增状态与高pCR显著相关。然而,当考虑HER2IHC亚组时,HER2基因扩增水平和pCR率的相关性消失。在本研究中,HER2蛋白过表达(IHC3+)是pCR的独立预测因子,而不同蛋白表达水平的HER2基因扩增则不是。这些结果表明,HER2蛋白过表达是抗HER2治疗反应的一个强有力的预测因子。其他研究也表明,相比HER2蛋白过表达患者,HER2非过表达但HER2基因扩增的患者pCR率更低(17%vs66%)[4,5]。
HER2蛋白过表达与抗HER2治疗反应之间的强相关性可能反映了HER2信号通路是由HER2蛋白过表达驱动,而不仅仅是由HER2基因扩增导致。因此,HER2蛋白表达处于临界水平的患者对针对HER2信号通路的治疗反应相对更有限,这些患者接受化疗联合抗HER2治疗的临床反应与HER2IHC2+/ISH-的患者仅接受化疗相比无显著差异。在III期CLEOPATRA研究中,HER2IHC3+与生存率提高相关[6]。这与本研究一致,与HER2IHC2+/ISH+乳腺癌患者相比,HER2IHC3+的患者在延长BCSS和DMFS方面更受益于抗HER2治疗。
与传统抗HER2治疗药物不同,HER2靶向ADC药物通过与肿瘤表面表达HER2的靶抗原结合,将细胞毒药物递送至表达HER2的肿瘤细胞中,抗肿瘤作用并不完全依赖于对HER2信号通路的阻断。III期KATHERINE研究显示,具有HER2表达异质性的患者(主要在HER2IHC2+中明显)在T-DM1组中的IDFS率与均一表达的患者(主要在HER2IHC3+中)相比非常接近(分别为89%和88%),而在曲妥珠单抗组中HER2表达异质性的肿瘤则获益较少[7]。但T-DM1的连接子不可裂解,不能对周围的HER2阴性细胞发挥抗肿瘤作用。而新一代ADC药物T-DXd等部分解决了这一问题,不仅在HER2阳性乳腺癌中展现强效抗肿瘤作用,而且在HER2低表达(IHC1+、IHC2+/ISH-)乳腺癌中也取得良好疗效,且这两种IHC亚型的结局相似[8,9]。
基于这些证据和本研究的结果,支持在治疗决策中考虑HER2IHC亚型对抗HER2治疗的反应差异,并且可在IHC2+/ISH+乳腺癌患者中开展进一步研究探索HER2靶向ADC药物相比曲妥珠单抗或其他HER2靶向药物的差异。
参考文献:
[1]AtallahNM,AlsaleemM,TossMS,etal.DifferentialresponseofHER2-positivebreastcancertoanti-HER2therapybasedonHER2proteinexpressionlevel.BrJCancer.2023Nov;129(10):1692-1705.
[2]KatayamaA,MiligyIM,ShiinoS,etal.Predictorsofpathologicalcompleteresponsetoneoadjuvanttreatmentandchangestopost-neoadjuvantHER2statusinHER2-positiveinvasivebreastcancer.ModPathol.2021Jul;34(7):1271-1281.
[3]DybdalN,LeibermanG,AndersonS,etal.DeterminationofHER2geneamplificationbyfluorescenceinsituhybridizationandconcordancewiththeclinicaltrialsimmunohistochemicalassayinwomenwithmetastaticbreastcancerevaluatedfortreatmentwithtrastuzumab.BreastCancerResTreat.2005Sep;93(1):3-11.
[4]Krystel-WhittemoreM,XuJ,BrogiE,etal.PathologiccompleteresponserateaccordingtoHER2detectionmethodsinHER2-positivebreastcancertreatedwithneoadjuvantsystemictherapy.BreastCancerResTreat.2019Aug;177(1):61-66.
[5]XuB,ShenJ,ZhangL,etal.HER2proteinexpressionlevelispositivelyassociatedwiththeefficacyofneoadjuvantsystemictherapyinHER2-positivebreastcancer.PatholResPract.2022Jun;234:153900.
[6]SwainSM,MilesD,KimSB,etal.Pertuzumab,trastuzumab,anddocetaxelforHER2-positivemetastaticbreastcancer(CLEOPATRA):end-of-studyresultsfromadouble-blind,randomised,placebo-controlled,phase3study.LancetOncol.2020Apr;21(4):519-530.
[7]DenkertC,LambertiniC,FaschingPA,etal.BiomarkerDatafromthePhaseIIIKATHERINEStudyofAdjuvantT-DM1versusTrastuzumabforResidualInvasiveDiseaseafterNeoadjuvantTherapyforHER2-PositiveBreastCancer.ClinCancerRes.2023Apr14;29(8):1569-1581.
[8]CortésJ,KimSB,ChungWP,etal.TrastuzumabDeruxtecanversusTrastuzumabEmtansineforBreastCancer.NEnglJMed.2022Mar24;386(12):1143-1154.
[9]ModiS,JacotW,YamashitaT,etal.TrastuzumabDeruxtecaninPreviouslyTreatedHER2-LowAdvancedBreastCancer.NEnglJMed.2022Jul7;387(1):9-20.
*本材料由阿斯利康提供,仅供医疗卫生专业人士参考
审批编号:CN-125938 有效期至:2024-12-5
*“医学界”力求所发表内容专业、可靠,但不对内容的准确性做出承诺;请相关各方在采用或以此作为决策依据时另行核查。
