真的“勇士”敢于「头对头」,国内药物头对头临床试验全盘点
转自:药渡
撰文:书本滑 编辑:安非他命
头对头研究选择已上市的药物做对照,是对两种药物临床价值的直接较量,头对头研究增多主要是因为创新药物开发提速,特别是同靶点的扎堆,内卷化严重,为了获得市场份额,开展头对头更能体现临床价值,从而挤占竞争对手的市场,但头对头的风险也较大,可谓是不成功便成仁。
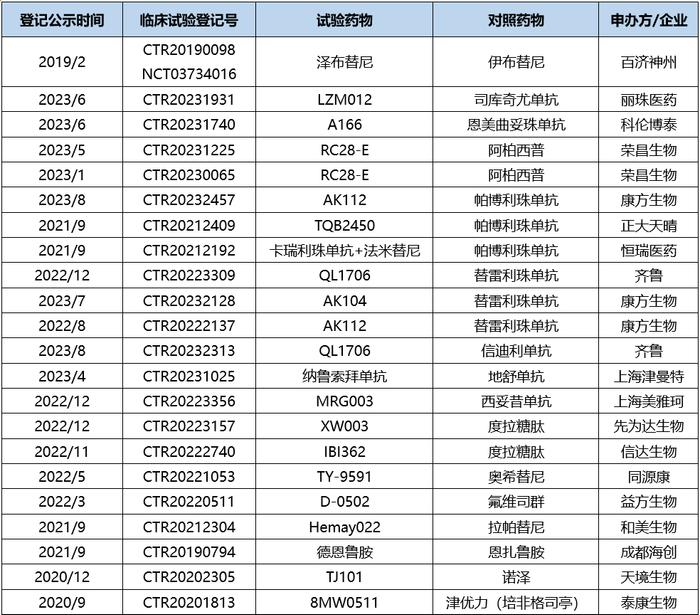
表1.头对头临床试验汇总,来源:临床试验登记平台clinicaltrial(时间:2020年-2023年9月,不完全统计)
01
泽布替尼VS伊布替尼
伊布替尼是全球首个上市的BTK抑制剂,于2013年11月获FDA批准上市,商品名为Imbruvica,适应症为套细胞淋巴瘤(mantlecelllymphoma,MCL),目前共批准慢性淋巴细胞白血病(CLL)成人患者、小淋巴细胞淋巴瘤(SLL)成人患者、携带del17p缺失突变的CLL成人患者、携带del17p缺失突变的SLL成人患者、华氏巨球蛋白血症成人患者、先前有治疗失败经历的慢性移植物抗宿主疾病等共7种适应症。
2014年,EMA陆续批准伊布替尼用于复发难治的MCL、CLL、WM等适应症。2017年8月,NMPA批准伊布替尼进口上市,商品名为亿珂,适应症为用于既往至少接受过一种治疗的套细胞淋巴瘤和慢性淋巴细胞白血病患者。
泽布替尼于2020年6月获得NMPA的批准上市,适应症为既往至少接受过一种治疗的成人套细胞淋巴瘤(MCL)患者;2021年批准新增适应症既往至少接受过一种治疗的成人华氏巨球蛋白血症(WM)患者,2023年4月批准新增适应症成人慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)一线治疗。
2018年百济神州启动全球多中心临床试验ALPINE,评估泽布替尼对比伊布替尼用于治疗既往经治的复发或难治性慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者的效果。共入组了652例患者(其中60%在欧洲入组,17%在美国入组,14%在中国入组,9%在新西兰和澳大利亚入组),主要终点是总缓解率(ORR),次要终点包括无进展生存期(PFS),为非劣效设计。结果显示,泽布替尼VS伊布替尼的ORR为83.5%VS74.2%。
02
LZM012VS司库奇尤
司库奇尤单抗(Secukinumab,AIN457),商品名可善挺®(Cosentyx®),人源化抗人白细胞介素-17A(IL-17A),可选择性地结合IL-17A并抑制其与IL-17受体相互作用,抑制促炎细胞因子和趋化因子的释放,进而降低IL-17A介导的自身免疫和炎性疾病的发生。
司库奇尤单抗于2014年12月首次在日本获准上市,2015年在美国、欧盟、加拿大和瑞士获批上市,2019年3月获得NMPA批准上市,适应症为用于治疗符合系统治疗或光疗指征的中度至重度斑块状银屑病的成年患者,2020年4月新增适应症,用于常规治疗疗效欠佳的强直性脊柱炎的成年患者。
目前我国尚未有IL-17A单抗上市,LZM012为丽珠医药开发的IL-17A单抗。2023年6月登记开展评价LZM012对比司库奇尤在中度至重度慢性斑块状银屑病受试者中的有效性与安全性,该试验为随机、双盲的III期临床研究,主要终点为以第12周时达到银屑病面积与严重程度指数(PASI)100的受试者比例(PASI100应答率)。
03
A166VS 恩美曲妥珠
A166为科伦博泰开发的HER2-ADC,适应症为既往经二线及以上抗HER2治疗失败的HER2阳性不可切除的局部晚期、复发或转移性乳腺癌。恩美曲妥珠单抗同为HER2-ADC,2013年获得FDA批准上市,2019年获得NMPA批准上市,是全球首个上市的ADC,也是中国首个上市的ADC。
科伦博泰于2023年6月登记开展评价A166对比恩美曲妥珠在既往接受过曲妥珠单抗和紫杉类药物治疗的HER2阳性不可切除或转移性乳腺癌患者的有效性。该试验为随机、开放标签的多中心研究,主要终点为PFS(无进展生存期),每6周评价一次。
04
RC28-EVS 阿柏西普
RC28-E是荣昌生物开发的VEGF/FGF双靶点融合蛋白药物,可同时阻断VEGF和FGF家族的血管生成因子,从而更有效地抑制血管异常生长,用于治疗湿性老年黄斑变性(wAMD)、糖尿病黄斑水肿(DME)和糖尿病性视网膜病变(DR)。
阿柏西普由拜耳开发,2011年获得FDA批准上市,为首个VEGF融合蛋白药物,2018年获得NMPA批准,商品名为艾力雅,目前是AMD和DME的标准疗法。
荣昌生物启动RC28-E与阿柏西普的头对头III期研究,2023年1月首先登记在湿性年龄相关性黄斑变性患者中评价,2023年5月登记在糖尿病性黄斑水肿患者中评价。
05
AK112、TQB2450、卡瑞利珠单抗+法米替尼VS帕博利珠
帕博利珠为默沙东开发的PD-1单抗,俗称K药。2014年FDA首先批准,用于经Ipilimumab治疗(若为BRAFV600突变阳性,则需接受过BRAF抑制剂治疗)后出现进展的晚期黑色素瘤患者,其后批准多种适应症,NMPA于2018年7月首次批准进口上市。目前,FDA共批准35个适应症,NMPA批准10个适应症。
AK112是康方生物自主研发的PD-1/VEGF双特异性抗体,TQB2450是正大天晴开发的一种PD-L1人源化单抗,卡瑞利珠单抗是由恒瑞自主开发的PD-1抑制剂,2019年4月首次获得NMPA批准,目前已批准4个适应症。
AK112
2023年8月,康方生物启动III期研究AK112联合化疗对比帕博利珠单抗联合化疗在一线治疗转移性鳞状非小细胞肺癌患者中的有效性,主要终点为OS(总生存期)。
TQB2450
2021年9月,正大天晴启动TQB2450联合安罗替尼对比帕博利珠在一线治疗晚期非小细胞肺癌患者中的有效性和安全性的随机、双盲、平行对照、多中心III期临床试验。主要终点为PFS(无进展生存期)。
卡瑞利珠单抗+法米替尼
2021年9月,恒瑞启动卡瑞利珠单抗联合苹果酸法米替尼对比帕博利珠单抗一线治疗PD-L1表达阳性的复发性或转移性非小细胞肺癌的随机、开放、对照、多中心的III期临床研究,主要终点为PFS(无进展生存期)。
06
QL1706、AK104、AK112VS 替雷利珠
替雷利珠单抗由百济神州开发,为PD-1抑制剂,NMPA首次于2019年12月批准,适应症为黑色素瘤,目前已批准10个适应症,为国产批准适应症最多的PD-1品种。
QL1706
QL1706为齐鲁开发的PD-1/CTLA-4双靶点抗体品种。2022年12月,齐鲁启动QL1706与替雷利珠的头对头研究,评价QL1706联合化疗一线治疗PD-L1表达阴性、局部晚期或转移性非小细胞肺癌患者的有效性和安全性,主要终点为PFS和OS。
AK104
AK104(卡度尼利)是康方生物开发的PD-1/CTLA-4双特异性抗体,2022年6月由NMPA批准上市,用于既往接受过含铂化疗治疗失败的复发或转移性宫颈癌患者。2023年7月,康方生物启动AK104联合化疗对比替雷利珠单抗联合化疗一线治疗PD-L1表达阴性非小细胞肺癌III期临床研究,主要终点为OS和PFS。
AK112
AK112是康方生物自主研发的PD-1/VEGF双特异性抗体。2022年8月,康方生物启动AK112对比帕博利珠单抗一线治疗PD-L1阳性的晚期非小细胞肺癌研究,主要终点为PFS。
07
QL1706VS信迪利单抗
上文提到齐鲁启动QL1706与替雷利珠头对头研究,同时在2023年8月启动与信迪利单抗的头对头对比。信迪利单抗为信达生物开发的PD-1抑制剂,于2019年12月获得NMPA批准,商品名为达伯舒。该头对头研究为QL1706联合用药对比信迪利单抗联合贝伐珠单抗在一线治疗晚期肝细胞癌患者中的有效性,主要终点为客观缓解率(ORR)。
08
纳鲁索拜单抗VS地舒单抗
地舒单抗是由安进公司开发的一种新型RANKL抑制剂,地舒单抗可作为骨巨细胞瘤的靶向治疗药物。2019年5月,NMPA有条件批准其进口上市,用于骨巨细胞瘤不可手术切除或者手术切除可能导致严重功能障碍的成人和骨骼发育成熟的青少年患者治疗。
纳鲁索拜单抗是由上海津曼特(石药全资子公司)开发的RANKL抑制剂,2023年4月启动与地舒单抗的头对头对比,评价纳鲁索拜单抗注射液对比地舒单抗治疗骨巨细胞瘤患者的疗效,该试验为非劣效设计,主要终点为反应率。
09
MRG003VS 西妥昔
MRG003是乐普生物/上海美雅珂开发的一款靶向EGFR的ADC药物,西妥昔是EGFR的单克隆抗体药物,2022年2月启动MRG003对比西妥昔单抗在既往接受过PD-1(L1)抑制剂和铂类药物治疗失败的复发或转移性头颈鳞癌患者中的有效性,主要终点为总生存期(OS)。
10
XW003、IBI362VS度拉糖肽
杭州先为达2022年12月启动XW003与度拉糖肽的头对头,信达生物于2022年11月启动IBI362与度拉糖肽的头对头,均是对比度拉糖肽在二甲双胍控糖效果不佳的2型糖尿病患者中的有效性。
11
TY-9591VS奥希替尼
TY-9591是由浙江同源康开发的不可逆的第三代EGFR(表皮生长因子受体)抑制剂,奥希替尼为阿斯利康开发的第三代EGFR(表皮生长因子受体)抑制剂,2015年首次获得FDA批准,2017年由NMPA批准。奥希替尼片为截至目前全球唯一兼具EGFR突变晚期非小细胞肺癌一线、二线和IB-IIIA期术后辅助治疗适应症的三代EGFR-TKI。
2022年5月,同源康启动评估TY-9591片对比奥希替尼一线治疗EGFR敏感突变的局部晚期或转移性非小细胞肺癌患者的疗效的III期临床试验,主要终点为无进展生存期(PFS)。
12
D-0502VS氟维司群
D-0502是口服选择性雌激素受体降解剂(SERD),和已上市的氟维司群同机制。
2022年3月,益方生物启动D-0502与氟维司群的头对头研究,对比D-0502与氟维司群在既往经治雌激素受体(ER)阳性、HER2阴性局部晚期或转移性乳腺癌患者中的有效性,主要终点为无进展生存期(PFS)。
13
Hemay022VS拉帕替尼
拉帕替尼是由GSK开发的酪氨酸激酶抑制剂,能有效抑制人类表皮生长因子受体-1(ErbB1)和人类表皮生长因子受体-2(ErbB2)酪氨酸激酶活性。于2007年3月获FDA批准上市,与卡培他滨联用,适用于HER2过表达且既往接受过包括蒽环类、紫杉类和曲妥珠单抗治疗的晚期或者转移性乳腺癌患者的治疗。
Hemay022是由和美药业开发的小分子EGFR/HER2酪氨酸激酶不可逆抑制剂,2021年9月,启动Hemay022联合来曲唑和依西美坦对比拉帕替尼联合卡培他滨用于晚期ER阳性和Her2阳性乳腺癌的有效性,主要终点为无进展生存期。
14
德恩鲁胺VS恩扎鲁胺
2021年9月,成都海创启动德恩鲁胺对比恩扎鲁胺对转移性去势抵抗性前列腺癌(mCRPC)的有效性试验,该临床试验为随机、双盲、全球多中心的III期研究,主要终点为总缓解率(ORR)。
15
TJ101VS诺泽
2020年12月,天境生物启动临床试验,对比TJ101和诺泽在儿童生长激素缺乏症受试者中的有效性与安全性。
16
8MW0511VS培非格司亭
8MW051是由江苏泰康生物开发的新一代长效G-CSF(高活性改构细胞因子),拟用于成年非髓性恶性肿瘤患者在接受容易引起发热性中性粒细胞减少症的骨髓抑制性抗癌药物治疗时,降低以发热性中性粒细胞减少症为表现的感染的发生率。
2020年9月,启动8MW0511对比津优力在乳腺癌患者中预防化疗引起的中性粒细胞减少症的有效性与安全性的研究,主要终点为4级中性粒细胞减少(即ANC<0.5×109/L)的持续时间。据报道,临床试验结果将在2023年度欧洲肿瘤内科学会(ESMO)年会中,以壁报报告形式公布。
总结
从国内企业开展的头对头研究中,可以总结出以下3点:
1)集中在市场竞争激烈的领域以及大市场而且选择对比药物为同机制靶点,比如PD-1、GLP-1;
2)开展的头对头也有层级,比如优效设计、非劣效设计,非劣效设计是一种偏保守的头对头,比如泽布替尼对比伊马替尼则是非劣效。
3)选用的主要终点是更具有临床价值的终点指标,还是偏保守的指标,比如是选用OS还是PFS甚至ORR。
