诺思格注册团队助力Orphalan5.1类新药盐酸曲恩汀片豁免临床在中国获批上市
转自:诺思格
2024年1月5日,国家药监局官网公示,Orphalan公司递交的5.1类新药盐酸曲恩汀片已正式获批上市,用于治疗青霉胺不耐受的≥5岁儿童及成人的肝豆状核变性(Wilson病)。这是一种罕见的常染色体隐性遗传的铜代谢障碍疾病,因肝脏铜转运受损而可能威胁生命,已于2018年5月在中国被纳入《第一批罕见病目录》。从2022年9月递交在中国申请上市,到2023年12月底正式获批,诺思格作为行业领先的CRO,注册团队为该产品提供了临床申报策略制定、申报资料撰写和申报、与监管部门沟通等NDA服务,成功获得优先审评审批以及豁免临床批准上市的成果,助力Orphalan公司的该品种成为中国首个批准的曲恩汀制剂。

肝豆状核变性又称Wilson病,是一种以铜代谢异常为特征的常染色体隐性遗传性疾病,目前尚无有效治疗手法。患有这种疾病的人被称为“铜娃娃”。这种疾病会造成人体内铜离子的运输与排泄障碍,并容易造成肝、脑损害,病人需要终生服药。
据了解,该产品是中国首个获批上市的曲恩汀制剂。盐酸曲恩汀是一款铜离子络合剂,可通过形成稳定的复合物消除体内吸收的铜,作用类似青霉胺,可以促使铜通过肾脏排泄出体外,减少铜的吸收。曲恩汀可以在青霉胺不耐受的情况下替代青霉胺,且曲恩汀透过血脑屏障的能力比现有治疗药物好,对于脑型患者显示出优势。此次豁免临床,并获得优先审批,加速产品在中国上市,为Wilson病成人及儿童患者带来更佳的治疗选择。
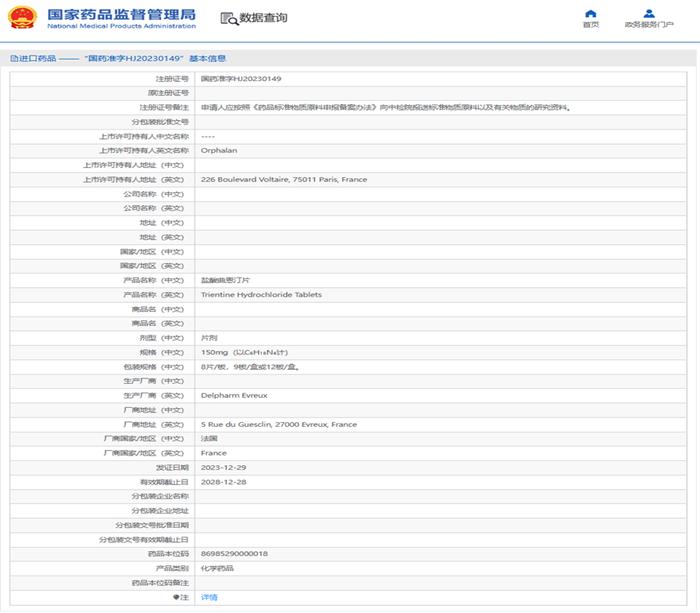
图片来源:国家药品监督管理局网站
在助力盐酸曲恩汀片成功NDA申报的过程中,诺思格注册团队与Orphalan团队紧密配合,制订了严谨的申报计划,多方面确保了项目顺利推进,为盐酸曲恩汀片成功豁免临床试验提供了关键且有力的支持,诺思格注册团队的专业能力也得到Orphalan团队的高度认可。
目前,诺思格注册事务部有着经验丰富的专家和团队,积累了近300个国内外注册项目经验,对国内、国际注册相关法规都有着深入研究和理解,依托团队丰富的经验和专业能力,可为全球医药研发企业提供新药临床开发及上市后全生命周期的注册服务。未来,诺思格将持续助力创新药的全球研发和注册上市,让更多创新药和优质疗法早日获批上市,惠及病患。
关于诺思格
诺思格(股票代码:301333SZ)作为根植中国,面向全球的知名CRO公司,以“为了人类的健康”为宗旨,坚持客户至上,秉承“科学性、专业性、创新性”的服务理念,为全球医药企业提供临床研发全方位、全链条的CRO服务,提高药物研发成功率,降低风险,节省费用,缩短周期,得到业内广泛赞誉。
诺思格自2008年创立,经过十五年坚持不懈的奋斗,打造出一支近2000人的优秀团队,成就了一个具有成熟企业文化的全新上市公司。旗下近十家子公司,涵盖注册事务、临床药理、医学事务和药物警戒、数据管理与统计分析、临床运营、中心管理、生物样本分析等业务。各专业领域由国内外顶级专家领衔,并组成公司“创新药科学与战略委员会”,为国内外药企定制研发策略和顶层设计,优化临床试验方案,指导中外新药申报,并取得了卓越成果。
迄今为止,诺思格已服务近千家医药企业,帮助众多医药器械产品,采用创新设计和科学方法,推动与CDE及FDA高效沟通交流,加速医药器械上市。在创新与监管国际化的潮流中,在以临床价值为导向的医药研发背景下,诺思格全体同仁将继续赋能全球医药企业,造福广大患者。
联系电话:010-88019151
