Nature子刊|杨朝勇/郑军华合作开发空间组学新技术破解肿瘤细胞早期空间侵袭模式
转自:生物谷
近日,上海交通大学医学院分子医学研究院杨朝勇团队和附属仁济医院泌尿科郑军华团队在NatureBiotechnology发表重要研究成果。该研究开发了一种高灵敏、高分辨的空间转录组学测序新技术Decoder-seq,并运用该技术探究了早期肾细胞癌(RCC)两种亚型肿瘤微环境的空间异质性,进一步解析了肿瘤细胞的早期空间侵袭模式。

肿瘤微环境是一个高度结构化的生态系统,成分复杂,且与肿瘤的生长、扩散、治疗应答等密切相关。因此,解析肿瘤微环境有助于揭示微环境中各类细胞的组成、空间分布及肿瘤细胞与其他细胞的复杂相互作用,对肿瘤发生、发展、耐药等机制研究具有重要意义。近年来,新兴的基于空间条形码阵列的空间转录组测序技术能够对组织切片进行原位空间编码,提供无偏好、高通量的全转录组分析,为肿瘤微环境解析提供了有力工具。然而,现有技术存在成本高、灵敏度低、分辨率差等瓶颈。
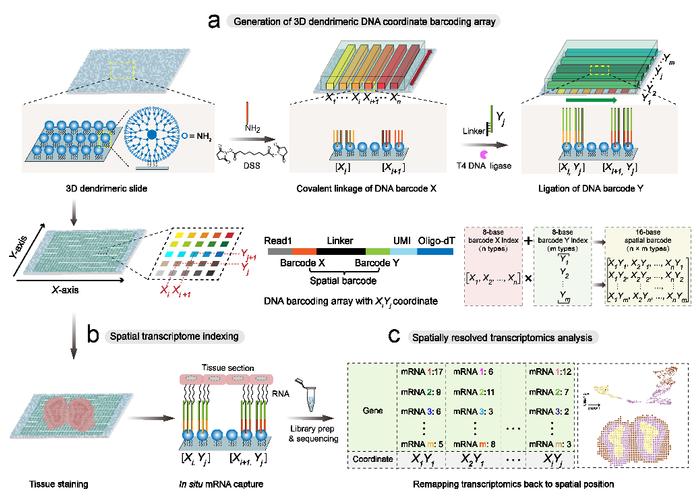
为解决这些难题,研究团队开发了一种空间转录组学新技术Decoder-seq,利用微流控辅助的正交编码策略,在3D纳米基底上生成了高密度空间条形码的阵列,实现了低成本、高灵敏、高分辨的空间转录组学研究。首先,Decoder-seq通过3D树状纳米基底将条形码的修饰密度提高约一个数量级,进而提高对组织mRNA捕获效率,从而提高了基因的检测灵敏度。其次,Decoder-seq利用微流控辅助编码,可生成空间分辨率灵活的编码点阵(50、25、15和10μm)。此外,正交编码策略生成的确定性组合条形码显著减少了编码DNA种类,且无需解码步骤,极大地降低实验成本。利用近单细胞分辨率(15μm)的Decoder-seq,可实现每μm2~40个mRNA分子的高灵敏检测,远高于其他同类方法。基于Decoder-seq高灵敏和高空间分辨的优势,实现对小鼠嗅球中低表达嗅觉受体基因的空间分布解析及海马体单细胞图谱的精确绘制。
研究团队采集了3例早期肾透明细胞癌(ccRCC)和2例早期肾嫌色细胞癌(chRCC)的肿瘤中心及肿瘤交界区共8个组织样品,应用Decoder-seq解析了肾细胞癌两种亚型的肿瘤微环境。首先,根据细胞类型和分子特征,共定义了七个细胞生态位(CN),揭示了两种亚型在细胞组成、免疫浸润模式和细胞间相互作用方面存在显著的空间差异。通过空间的免疫评分分析发现,免疫抑制或浸润不仅与样本亚型有关,还与组织空间分布有关。此外,还发现CN5中的肿瘤细胞表现出一种从肿瘤中心到侵袭边缘再到正常区域的向外播散模式,这与肿瘤细胞的侵袭性生长特征一致。而且,在侵袭边缘区的CN5,肿瘤细胞与免疫细胞间有强烈相互作用;而在基质+正常区域呈现耗竭态CD8+T细胞的上调,利于肿瘤细胞逃避免疫监视。根据CN5在扩散方向上的空间梯度上调基因,鉴定出一组空间梯度表达EMT的相关基因(dEMT,27个)。dEMT在CN5的基质区域广泛分布,表明这类区域可能作为肿瘤侵袭的“土壤”。值得注意的是,更高的dEMT得分还与RCC的不良预后和更高的肿瘤分期显著相关,为理解肿瘤发展和治疗提供了重要思路。
该研究由上海交通大学医学院分子医学研究院杨朝勇团队及附属仁济医院泌尿科郑军华团队强强合作完成。仁济医院博士后曹姣,博士生郑重,博士后孙迪为共同第一作者;杨朝勇教授,副研究员吴玲玲、宋佳以及郑军华教授为共同通讯作者。该研究得到了国家自然科学基金、国家科技部重点研发计划、上海地方高水平大学创新研究团队等项目的资助。
全文链接:https://doi.org/10.1038/s41587-023-02086-y
