【征求意见】个例安全性报告实施指南问答中文版发布
2023-05-19 19:29:25 - 市场资讯
转自:蒲公英Ouryao
2023年05月19日,国家药品监督管理局药品评价中心发布了关于公开征求个例安全性报告(ICSRs)E2B(R3)实施指南问答文件V2.4中文翻译稿意见的通知,征求意见为期15天。
主要内容

国际人用药品注册技术协调会(ICH)于2023年初更新了个例安全性报告(ICSRs)E2B(R3)实施指南问答,形成了2.4版本问答文件,我中心近期组织开展了该文件的中文翻译工作,现对中文翻译稿公开征求意见(主要内容涉及第4章节ICHE2B(R3)数据元素的4.23部分),具体内容如下:
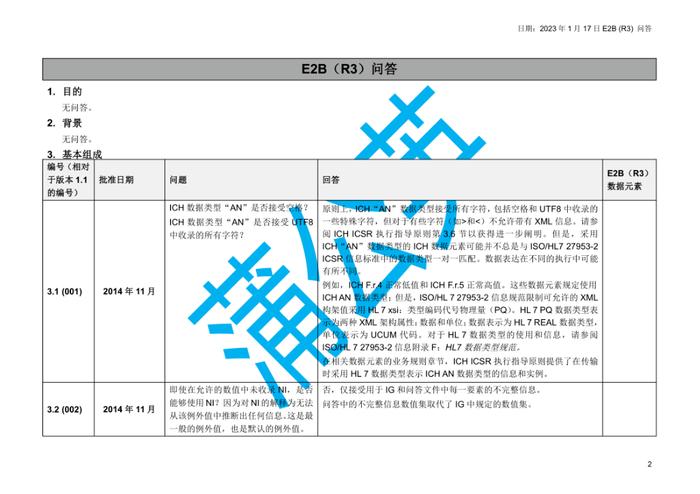
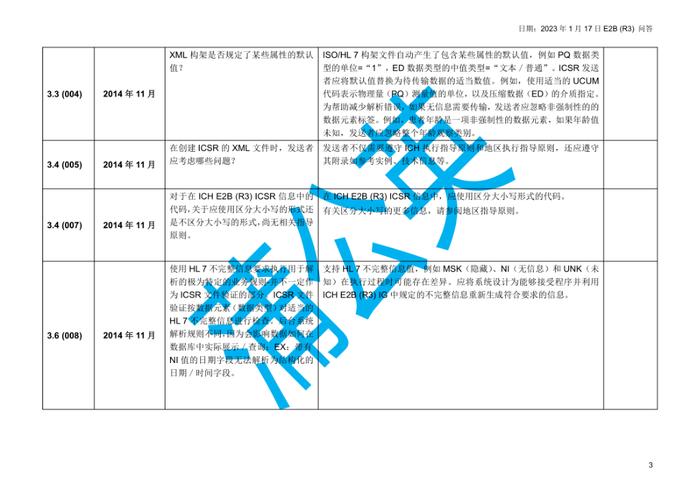
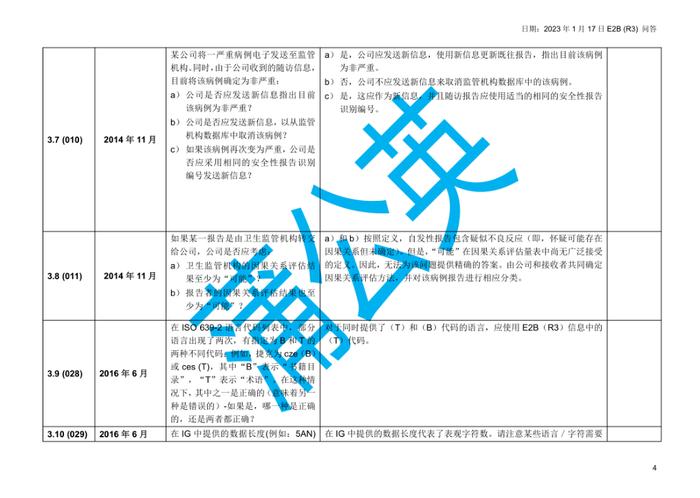
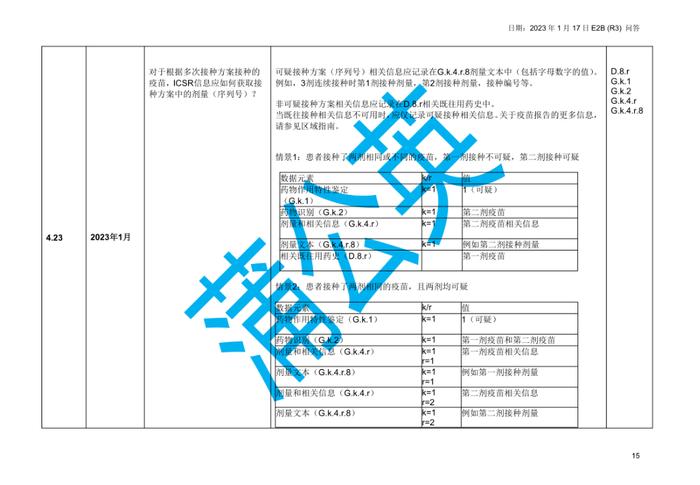


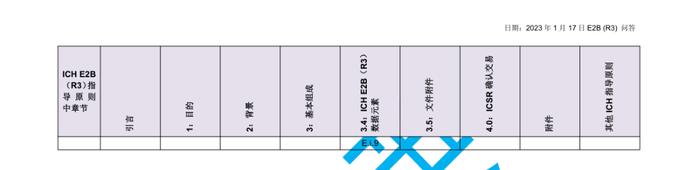
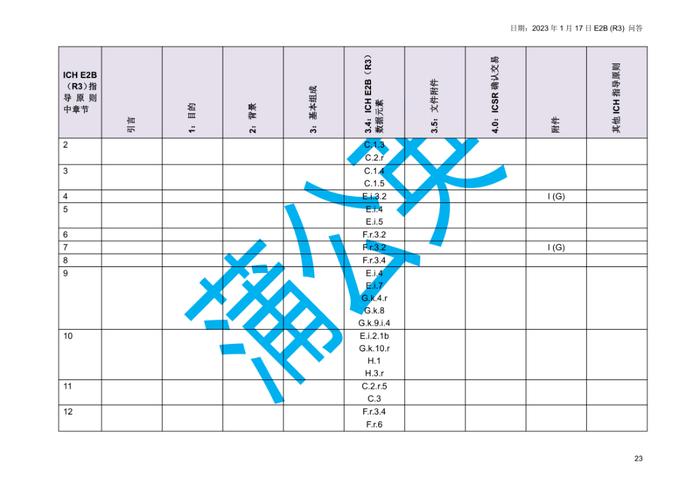
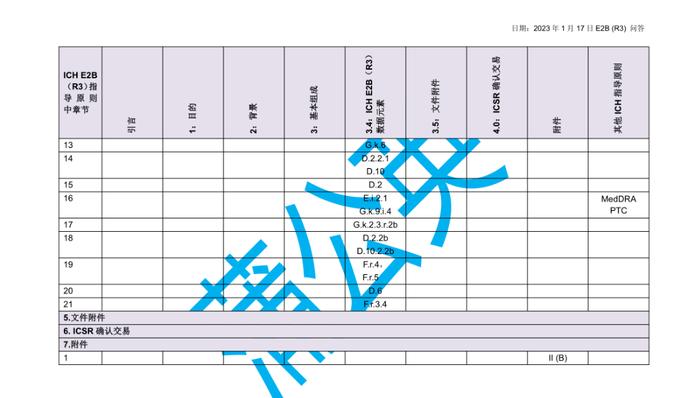
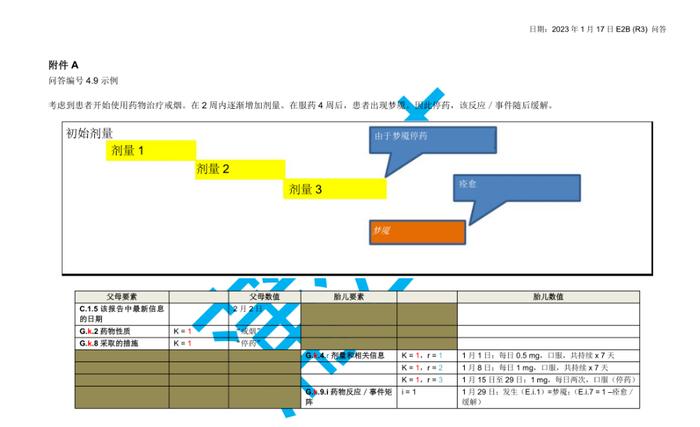
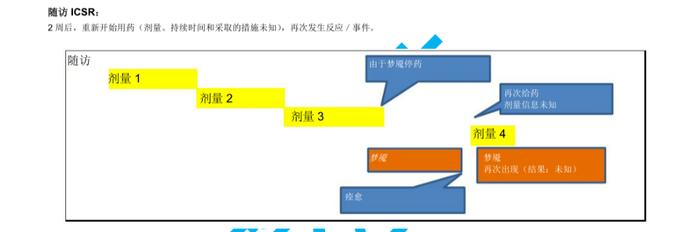
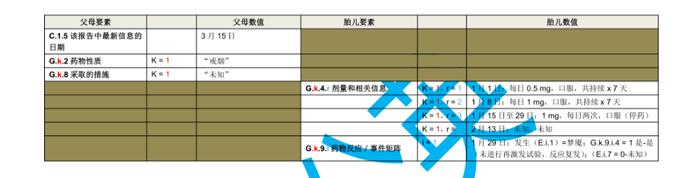
公开征求意见为期15天,如有意见请反馈至电子邮箱:E2B@cdr-adr.org.cn。
