一文解析ADC药物耐药机制有哪些
转自:医学界
最新综述报道ADC药物耐药性与抗原表达、ADC加工以及有效载荷有关。
抗体药物偶联物(ADC)由特异性靶向单克隆抗体和高活性细胞毒药物通过连接子偶联而成,凭借着独特的药学特性,ADC药物在抗肿瘤治疗领域展现出强大抗肿瘤活性的同时,具有相比传统化疗更高的安全性。近年来,ADC药物在抗肿瘤治疗领域的发展十分迅猛,尤其在HER2阳性乳腺癌治疗领域,ADC药物带来的显著获益革新了乳腺癌治疗格局,更为患者提供了强有力的治疗新选择。尽管ADC的临床表现十分优异,但仍然面临着耐药问题。有综述报道表明[1],ADC药物耐药性与抗原表达、ADC加工以及有效载荷有关。现将相关研究内容梳理如下,以飨读者。
ADC耐药机制
根据ADC的复杂结构对潜在耐药机制进行分类,下表总结了拟定的临床前和临床耐药机制,根据抗原表达变化、ADC加工和有效载荷变化进行分类。采用这种方法对耐药机制进行分类为未来的研究提供了方向,有助于进一步了解这些机制和药物开发的新靶点,从而扩大ADC的疗效。
表1.耐药机制的分类
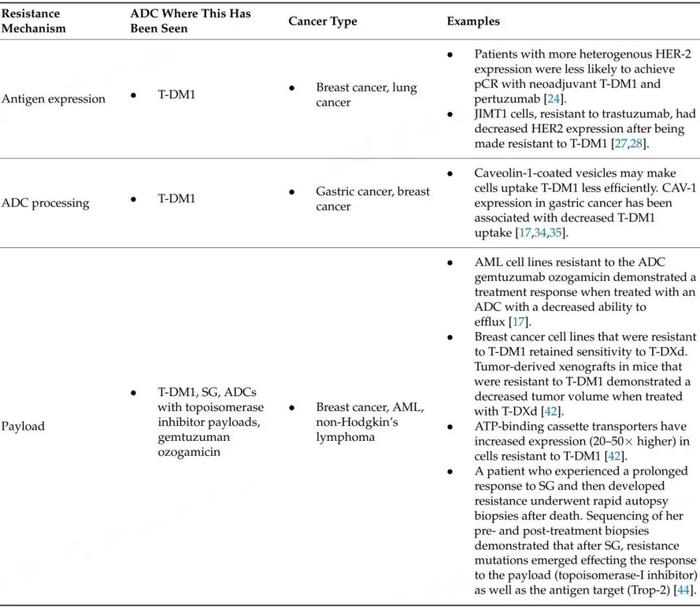
抗原表达
在T-DM1的早期试验中,观察到HER2表达水平更高和更均一的肿瘤更有可能对治疗产生反应。考虑到HER2表达可能具有异质性,并且在16%-36%的病例中报告了肿瘤内异质性。对于需要HER2表达均质性的治疗药物,当HER2水平发生任何变化时,都可能面临耐药的发生。该假设的进一步证据包括观察到HER2阳性肿瘤在治疗后表现出较低的HER2表达,并且更多的异质性表达与较高的复发率和较低的生存率相关[2]。一项对接受T-DM1和帕妥珠单抗新辅助治疗的早期HER2阳性乳腺癌患者的研究发现,治疗前存在HER2异质性(定义为5-50%肿瘤细胞中ERBB-2扩增或HER2-FISH阴性区域)可反向预测治疗反应。事实上,在治疗前活检具有异质性的患者中,0%获得了病理学完全缓解,而联合使用T-DM1和帕妥珠单抗时,发现55%的非异质性患者达到pCR[3,4]。此外,T-DM1耐药患者的循环肿瘤DNA(ctDNA)显示HER2扩增较少的肿瘤细胞[5,6]。
抗原表达下降可介导ADC耐药这一假说的进一步证据来自临床前细胞系。使用对曲妥珠单抗耐药的JIMT1细胞构建对高浓度T-DM1有反应的异种移植肿瘤,然后使用周期性T-DM1处理这些肿瘤以产生耐药性,随后的检测表明HER2表达降低[7,8]。在胃癌细胞模型中,一个临床前示例表明旁观者效应在克服抗原表达下降中的重要性。这些细胞对T-DM1产生耐药性,然后表现出对具有不可裂解连接子的ADC的耐药性,同时保留对具有可裂解连接子和细胞渗透性有效载荷的ADC的敏感性[9]。JIMT1细胞系的类似研究确定恢复HER2表达可逆转对T-DM1的耐药性。
除抗原表达水平异常外,抗原与另一种细胞表面受体的二聚化可能能够介导对ADC的耐药性。NRG-1β是一种已知可引起HER2/HER3异二聚体化的配体,在HER2扩增的乳腺癌细胞系亚群中可抑制T-DM1的细胞毒活性。这种耐药性可以通过加入帕妥珠单抗来克服,帕妥珠单抗是一种抗HER2单克隆抗体,可阻断HER2/HER3二聚化和下游信号传导。在体外和体内肿瘤异种移植模型研究中,T-DM1与帕妥珠单抗联合给药显示出协同效应[10]。另一种策略利用ADC中的双特异性抗体,涉及识别靶抗原不同表位的两个臂。这表明REGN5093-M114(一种双特异性MET靶向ADC,正在MET过表达EGFR突变NSCLC细胞系中进行研究)的临床前研究获得成功。
T-DXd与T-DM1具有明显的结构差异,T-DXd包括膜渗透性有效载荷和可裂解连接子,基于此特性,T-DXd具有旁观者效应,释放的有效载荷能够穿透邻近肿瘤细胞发挥抗肿瘤作用,这也是T-DXd克服T-DM1耐药性的重要机制之一。
鉴于抗原异质性在介导ADC耐药中的影响,未来解决这种耐药的策略可能包括具有双抗体的药物(双特异性ADC)。此外,有利于增加抗原表达的联合治疗可能具有价值。在一项ERBB2扩增或突变肺癌的研究中,观察到当T-DM1和不可逆泛HER激酶抑制剂奈拉替尼联合治疗时,肺癌细胞对T-DM1的摄取增加,但当使用可逆HER2抑制剂拉帕替尼时,观察到T-DM1的摄取减少。
ADC加工
ADC的复杂性,尤其是与小分子相比,为出现耐药性提供了许多可能的机会(图1)。在许多情况下,特别是在具有不可裂解连接子的ADC中。在ADC释放有效载荷之前,其通常结合靶抗原,然后经内化进入肿瘤细胞,并在细胞内进行加工、处理。在临床前研究中,某些耐药原因,尤其是细胞内机制难以证明是耐药的驱动因素,但根据治疗耐药模型的观察结果得出了推论[8]。提出的介导ADC耐药的假说涉及细胞内摄取和加工的改变。在ADC进入细胞之前,提出的一种机制涉及通过屏障减少对细胞的渗透,包括细胞基底膜的增加[8]。另一个提出的机制来自最近的临床前工作,证明异常的内体转运可能参与T-DM1耐药[4]。ADC确保特异性的一种机制是通过表达靶抗原的细胞中网格蛋白介导的内吞摄取。在对T-DM1耐药的N89-TM细胞系中,发现了一种摄取的替代机制,其中细胞使用小窝蛋白-1(CAV1)包被的囊泡,其效率可能较低[11,12]。与这一观察结果一致,最近在胃癌中的一项研究发现肿瘤CAV1水平与T-DM1肿瘤摄取呈负相关。在多个异种移植模型中,CAV1的遗传或药理学抑制增加了T-DM1摄取,并与T-DM1协同作用[13]。此外,糖胺聚糖修饰通过促进膜脂筏中CAIX与CAV1的结合,负性调节肿瘤抗原CAIX和抗CAIXADC的内化。在药理学上抑制蛋白糖胺聚糖修饰可增加抗CAIXADC内化和细胞毒活性。在另一项不同的研究中,由于pH值的变化,ADC到达溶酶体后,观察到对T-DM1耐药的细胞缺乏蛋白水解活性,导致模拟溶酶体贮积病的药物蓄积。
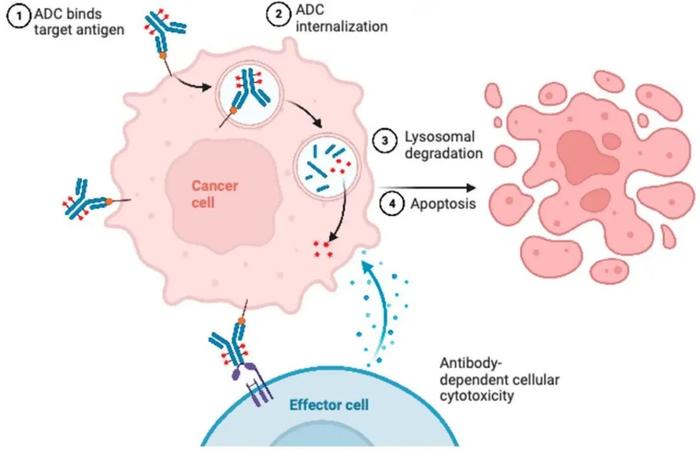
发现对T-DM1耐药的JIMT1-TM细胞系中包括Rab5B、ATG9a和HTT在内的蛋白增加,其介导溶酶体加工和囊泡的转运。蛋白质组学分析显示,Rab6(一种参与微管介导转运的蛋白)和细胞骨架张力相关蛋白PAK4的蛋白水平特别高。为了扩展这些发现,在活细胞成像显微镜下观察JIMT1-TM细胞以及361-TM细胞系。对于361-TM细胞系,与对T-DM1不耐药的亲本细胞相比,具有不可裂解连接子的ADC在溶酶体中花费的时间显著更长,提高了关于ADC加工效率较低的认识。有趣的是,在具有可裂解连接子的ADC中未观察到该结果,表明了克服耐药性的机制。在JIMT1-TM细胞系中,含可裂解和不可裂解连接子的ADC均表现出较长的协同作用。发现对T-DM1耐药的JIMT1-TM细胞系中蛋白增加,包括Rab5B、ATG9a和HTT,其介导溶酶体加工和囊泡转运。蛋白质组学分析显示蛋白水平特别高,包括参与微管介导转运的蛋白Rab6和细胞骨架相关蛋白PAK4。为了扩展这些发现,在活细胞成像显微镜下观察JIMT1-TM细胞以及361-TM细胞系。对于361-TM细胞系,与对T-DM1不耐药的亲本细胞相比,具有不可裂解连接子的ADC在溶酶体中花费的时间显著更长,这引起了学者对ADC加工效率较低的关注。有趣的是,在具有可裂解连接子的ADC中未观察到该结果,表明了克服耐药性的机制。在JIMT1-TM细胞系中,含可裂解和不可裂解连接子的ADC在溶酶体中的共定位均长于亲本细胞。不出所料,与亲本细胞相比,发现两种耐药细胞系的连接子-有效载荷代谢物均减少,但尚不确定这是由HER2表达减少、ADC加工减少还是两者共同驱动。与有效载荷释放可能涉及不同ADC取决于连接子状态的观点相一致,最近一项利用CRISPR筛选的研究证明,含可裂解连接子的ADC在ADC摄取后立即被快速加工,并被运输到早期内体中,而含不可裂解连接子的ADC需要进一步的溶酶体递送才能成功释放有效载荷。另外有文献报道,唾液酸的耗竭通过增强ADC溶酶体递送(可能通过减少ADC再循环)促使细胞对ADC毒性敏感[14]。
载药
观察到的一些耐药机制涉及有效载荷本身,可以通过使用具有替代有效载荷的ADC来克服。例如,拓扑异构酶抑制剂有效载荷的ADC耐药性可由拓扑异构酶表达变化或下游信号传导机制变化驱动(图2)。
在非霍奇金淋巴瘤的肿瘤模型中也观察到了这一点,将包含基于auristatin有效载荷的ADC替换为基于蒽环类药物的有效载荷的ADC有助于患者接受ADC治疗的进一步反应。同样,在对T-DM1耐药的乳腺癌细胞中,肿瘤细胞对T-DXd仍然敏感。为了跟踪这些结果,采用针对T-DM1敏感和耐药的细胞建立小鼠肿瘤异种移植物模型。由T-DM1耐药细胞构建的异种移植物模型对T-DM1不敏感,但当用T-DXd处理时,这些小鼠表现出肿瘤体积减小[15]。该理论的应用包括开发其他HER2靶向或者TROP-2靶向ADC,这些药物均可能提供替代的有效载荷,从而克服有效载荷相关耐药。
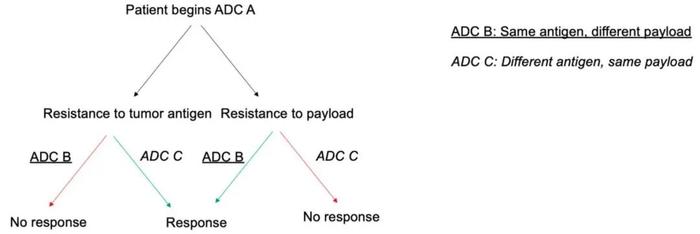
在患者接受ADC治疗时进行全外显子测序的能力允许实时追踪耐药突变的发展,并为未来的治疗提供理论上的策略支持。例如,有研究评估了1例对SG反应延长(超过8个月)的患者的耐药机制,该患者在开始该治疗前接受过全外显子测序。进展后行快速尸检取材,并将治疗前后标本与SG进行比较。对治疗后发生的突变进行的分析表明,肿瘤亚克隆携带TOP1突变(编码拓扑异构酶-1,SG有效载荷的靶标),以及独特的亚克隆携带TACSTD2突变(编码TROP-2,SG的抗原靶标)。这些发现意味着存在针对ADC抗体和有效载荷的平行耐药机制,该结果表明肿瘤细胞可能对序贯ADC耐药,包括具有相似有效载荷或相似抗体靶标的ADC[16]。未来得益于靶向和快速测序方面的创新,可以根据患者从以前的治疗中产生的耐药突变,为患者提供个性化的治疗指导。
由ATP结合盒转运蛋白介导的ADC有效载荷外排增加是另一种可能的耐药机制。与亲本细胞相比,在T-DM1耐药细胞中观察到转运蛋白表达增加,高达20-50倍。在AML细胞模型中观察到该机制,作为对吉妥珠单抗(GO)耐药的一种手段。同样,编码ATP结合盒的ABCB1水平较低的患者对GO的反应改善。在不同的细胞系中,对T-DM1产生耐药性后,基因ABCC1的表达增加。最后,在紫杉醇耐药癌细胞系的临床前模型中,紫杉类衍生物有效载荷的ADC耐药与ABCB1过表达介导的TUBB3活化相关。
已经提出了多种可能的临床前和临床机制来解释这些耐药手段,研究发现对T-DM1耐药的细胞系对具有不可裂解连接子的曲妥珠单抗导向、基于auristatin的ADC同样表现出耐药性。当编码药物外排泵ABCC1的MRP1被siRNA逆转或敲低时,肿瘤细胞表现出对含有不可裂解连接子的ADC的新敏感性。有趣的是,在对GO耐药的AML细胞中,当使用外排潜力较差的细胞毒性药物vadastuximabtalirine代替时,出现了新的缓解。在ADC治疗9个月后,使用RNAseq分析临床前乳腺癌小鼠模型,该模型使用抗nectin-4靶向ADC(称为N41mab-vc-MMAE)治疗。此外,在该模型中,ABCB1上调。当ADC与P-gp药理学抑制剂tariquidar联合给药时,观察到快速的治疗反应,其耐受性显著优于tariquidar和多西他赛联合给药[17]。
结论
虽然ADC的问世为肿瘤患者提供了新的治疗选择,但大多数肿瘤最终会对这些药物产生耐药性。最近的临床前模型和临床分析试图模拟这些耐药机制,旨在开发出能够克服和改善这些耐药性的新型治疗策略。鉴于ADC的复杂性,涉及抗原表达减少、ADC转运和加工减少、对细胞毒性有效载荷耐药和药物外排增加均可能成为其潜在耐药机制。未来克服对ADC初始耐药性的努力应建立在所述机制的基础上。正在进行的优化ADC序贯治疗和联合治疗的研究将有望为这些药物的最佳使用提供更多线索。总之,相关探索例证了转化研究在提示新的治疗选择和可能改善患者的临床结局方面的前景。
参考文献:
[1]AbelmanRO,WuB,SpringLM,etal.MechanismsofResistancetoAntibody-DrugConjugates.Cancers(Basel).2023Feb17;15(4):1278.
[2]YamazakiCM,YamaguchiA,AnamiY,etal.Antibody-drugconjugateswithdualpayloadsforcombatingbreasttumorheterogeneityanddrugresistance.NatCommun.2021Jun10;12(1):3528.
[3]FilhoOM,VialeG,SteinS,etal.ImpactofHER2HeterogeneityonTreatmentResponseofEarly-StageHER2-PositiveBreastCancer:PhaseIINeoadjuvantClinicalTrialofT-DM1CombinedwithPertuzumab.CancerDiscov.2021Oct;11(10):2474-2487.
[4]SwainSM,ShastryM,HamiltonE.TargetingHER2-positivebreastcancer:advancesandfuturedirections.NatRevDrugDiscov.2023Feb;22(2):101-126.
[5]HunterFW,BarkerHR,LipertB,etal.Mechanismsofresistancetotrastuzumabemtansine(T-DM1)inHER2-positivebreastcancer.BrJCancer.2020Mar;122(5):603-612.
[6]SakaiH,TsurutaniJ,IwasaT,etal.HER2genomicamplificationincirculatingtumorDNAandestrogenreceptorpositivitypredictprimaryresistancetotrastuzumabemtansine(T-DM1)inpatientswithHER2-positivemetastaticbreastcancer.BreastCancer.2018Sep;25(5):605-613.
[7]AbelmanRO,WuB,SpringLM,etal.MechanismsofResistancetoAntibody-DrugConjugates.Cancers(Basel).2023Feb17;15(4):1278.
[8]LoganzoF,TanX,SungM,etal.Tumorcellschronicallytreatedwithatrastuzumab-maytansinoidantibody-drugconjugatedevelopvariedresistancemechanismsbutrespondtoalternatetreatments.MolCancerTher.2015Apr;14(4):952-63.
[9]SungM,TanX,LuB,etal.Caveolae-MediatedEndocytosisasaNovelMechanismofResistancetoTrastuzumabEmtansine(T-DM1).MolCancerTher.2018Jan;17(1):243-253.
[10]PhillipsGD,FieldsCT,LiG,etal.DualtargetingofHER2-positivecancerwithtrastuzumabemtansineandpertuzumab:criticalroleforneuregulinblockadeinantitumorresponsetocombinationtherapy.ClinCancerRes.2014Jan15;20(2):456-68.
[11]García-AlonsoS,OcañaA,PandiellaA.ResistancetoAntibody-DrugConjugates.CancerRes.2018May1;78(9):2159-2165.
[12]SungM,TanX,LuB,etal.Caveolae-MediatedEndocytosisasaNovelMechanismofResistancetoTrastuzumabEmtansine(T-DM1).MolCancerTher.2018Jan;17(1):243-253.
[13]PereiraPMR,MandleywalaK,MonetteS,etal.Caveolin-1temporalmodulationenhancesantibodydrugefficacyinheterogeneousgastriccancer.NatCommun.2022May9;13(1):2526.
[14]TsuiCK,BarfieldRM,FischerCR,etal.CRISPR-Cas9screensidentifyregulatorsofantibody-drugconjugatetoxicity.NatChemBiol.2019Oct;15(10):949-958.
[15]TakegawaN,NonagaseY,YonesakaK,etal.DS-8201a,anewHER2-targetingantibody-drugconjugateincorporatinganovelDNAtopoisomeraseIinhibitor,overcomesHER2-positivegastriccancerT-DM1resistance.IntJCancer.2017Oct15;141(8):1682-1689.
[16]CoatesJT,SunS,LeshchinerI,etal.ParallelGenomicAlterationsofAntigenandPayloadTargetsMediatePolyclonalAcquiredClinicalResistancetoSacituzumabGovitecaninTriple-NegativeBreastCancer.CancerDiscov.2021Oct;11(10):2436-2445.
[17]CabaudO,BergerL,CrompotE,etal.OvercomingResistancetoAnti-Nectin-4Antibody-DrugConjugate.MolCancerTher.2022Jul5;21(7):1227-1235.
审批号:CN-118062 过期日期:2024-7-4
材料由阿斯利康支持,仅供医疗卫生专业人士参考
