一款救命药将退出中国市场,罕见病患者用药难在哪
转自:北京商报
2024年2月29日,是第十七个国际罕见病日,但上百个黏多糖贮积症ⅣA型患者的家庭,正在面临断药的绝境。据悉,该罕见病在全国14亿人中仅有100余人确诊,患者多为孩子。全球唯一治疗药物“唯铭赞”将于今年5月退出中国市场。这一疾病用药难的现象也折射出了罕见病药物市场的困境,确诊难、研发投入大以及商业回报的不确定性都是药物研发的痛点。在给患者家人的答复中,“唯铭赞”生产商称,尽管过去几年公司已尽努力,但深感在“唯铭赞”用药治疗费用支付方式的商讨中,切实可行的机会有限,因此决定不就该产品的上市许可(即进口药品注册证)进行再注册。

注册证将于5月到期
一款罕见病用药即将退出中国市场。黏多糖贮积症ⅣA型作为一种典型的罕见病,是已知的40多种不同的溶酶体贮积病的一种,是黏多糖贮积症Ⅳ型或MPSⅣ的一种形式。而“唯铭赞”(Vimizim,依洛硫酸酯酶α)是目前全球唯一获批用于治疗黏多糖贮积症IVA型(MPSⅣA)的药物。
确诊人数不到总人口0.0001%的疾病也称“超罕见病”。世界卫生组织将罕见病定义为患病人数占总人口0.065%—0.1%的疾病。其中还有一些疾病,如溶酶体贮积症(LSDs)中的戈谢病、庞贝病、法布雷病等,目前国内确诊的患者人数仅数百人,即确诊人数不到总人口的0.0001%,不足百万分之一。
2019年,“唯铭赞”获国家药品监督管理局上市批准,被列入我国第一批《临床急需境外新药名单》,其定价为7500元一支(5mg)。该药物的用药剂量依据患者的体重决定,以一个体重25斤的孩子为参考,年治疗费在200万元左右。
据报道,“唯铭赞”作为高值药物曾出现在2021年的医保谈判预选名单中,但最终谈判失败,2022年未参与医保谈判,只纳入了部分地方医保及惠民保。随后,市场传来该药品厂商百傲万里制药已决定不再为其在中国的进口药品注册证续期消息,注册证将于2024年5月到期。
百傲万里制药对此给出的解释为,“复杂的市场准入规则使得药物的供应不可持续,特别是在罕见病治疗方面。尽管我们在过去几年中尽了最大努力,仍然没有促使药品进入医保报销体系,我们决定不再续签该产品的进口药品注册证”。
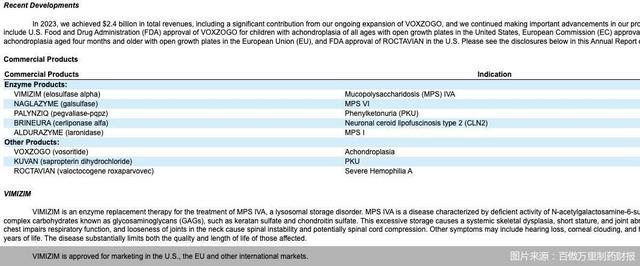
北京病痛挑战基金会信息研究总监郭晋川告诉北京商报记者,患者本身数量少,国内黏多糖贮积症在患者组织处登记的人数可能为400—500人。根据病人症状和影像学表现的不同,该疾病有7种分型,一种分型的患者数量可能在100人左右。患者人数少,加之药物价格高昂,患者负担不起,企业对市场前景没有信心,故而战略性放弃部分市场。
据2023年财报数据显示,百傲万里制药全年实现营收24.19亿美元,其中“唯铭赞”全球营收达7.01亿美元,主要由美国和欧洲市场推动。
破解用药难题
“唯铭赞”用药难只是罕见病市场的一角。《2024中国罕见病行业趋势观察报告》显示,“诊疗难”和“保障难”是横亘罕见病患者治疗之路的两座大山。从全球范围来看,目前仅有5%的罕见病存在有效治疗方法,即使已存在治疗方法的罕见病药物价格也十分昂贵,一般患者很难负担。
作为国际难题,我国罕见病患者面临的诊疗困境更甚。《2024中国罕见病行业趋势观察报告》提到,这包括疾病难以诊断、疾病诊断后尚无特效治疗手段、治疗药物未在国内上市、治疗药物已在国内上市但未注册罕见病适应症、治疗药物已在国内上市但缺乏医保支付等。
唯铭赞退市一定程度反映了罕见病研发难的困境。郭晋川表示,对罕见病药品来说,企业研发成本很高,如果其选择在一个市场上市,期待能在上市后看到合理的回报,从研发、上市到销售,最终患者能用上药,形成产业闭环。若其中一环缺失,没有人购买或者没有稳定的支付渠道,企业看不到合理的回报,就会动力不足。
“对跨国药企来说,只是市场‘一城一地’的得失,然而对罕见病患者来说,则是失去了用药机会,最终受影响最深的还是患者群体。”郭晋川进一步说道。
一位跨国药企人士提到,药物上市不仅有研发成本、生产成本、教育推广成本,还有诊断成本、患者援助成本以及进口药检的成本等。
近年来,政府主导、社会多方力量参与,助力解决罕见病患者少药及保障不足的难题。这包括一系列与罕见病相关的政策出台,鼓励相关药物引进、研发和生产,以及积极探索罕见病用药保障模式。
据介绍,地方政府比如深圳市积极探索惠民保升级保障,以病痛挑战基金会为代表的公益慈善力量也积极参与,通过“罕见病医疗援助项目”,助力罕见病患者用药可及。此外,还有医药企业等开展的PAP(患者援助项目)和TPA(第三方服务项目也从一定程度上减轻了患者的用药负担。
沙利文大中华区生命科学事业部咨询总监李谦表示,中国积极构建多层次罕见病药物开发策略,推动罕见病药物上市。2023年中国共上市45款罕见病药物,其中15款通过优先审评审批路径上市。目前中国也有27款罕见病药物正在上市申请中,同时进入临床Ⅲ期的管线数量达到了70条。同2022年相比,2023年罕见病领域药物研发覆盖范围更广、数量更多。
北京商报记者姚倩
