两款细胞治疗产品出自复星医药和药明巨诺 | 公司研究
CAR-T疗法是一种治疗肿瘤的新型精准靶向疗法,其英文全称为ChimericAntigenReceptorT-CellImmunotherapy,在血液恶性肿瘤(如白血病、淋巴瘤、多发性骨髓瘤等)中有极佳的效果,尤其是在2021年阿基仑赛注射液、瑞基奥仑赛注射液先后在中国获批上市,2022年西达基奥仑赛获美国FDA批准上市,CAR-T疗法成为目前比较热门的细胞疗法之一。通常操作是:从患者身上取出T细胞(T淋巴细胞),通过基因工程将其改造为可以识别并杀死相应肿瘤细胞的CAR-T细胞,经过扩增生产后,将其通过静脉输液的方式重新输回患者体内。
据国家药监局网站信息,今年11月合源生物申报的纳基奥仑赛注射液通过优先审评审批程序附条件获批,适应症为成人复发或难治性B细胞急性淋巴细胞白血病,成为获得国家药监局批准的第4款CAR-T产品。此前,国内已有3款产品获批,分别为复兴医药旗下的阿基仑赛注射液产品奕凯达®、药明巨诺旗下的瑞基奥仑赛注射液产品倍诺达®和驯鹿生物旗下的伊基奥仑赛注射液产品福可苏®。分析指出,伴随更多CAR-T产品获批,预计市场规模于2030年可以达到289亿元。
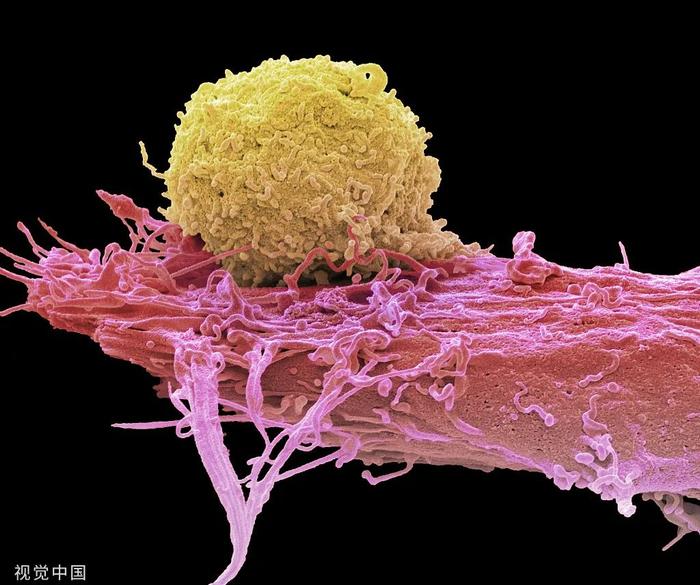
2017年复星医药(600196)与美国KitePharma合营成立复星凯特,(KitePharma已经退市现为吉利德科学GILD.O旗下子公司),2021年6月复星凯特获批上市中国首个基于阿基仑赛注射液的CR-T细胞治疗产品--奕凯达®,成功治疗超600位复发/难治性大B细胞淋巴瘤患者。复兴医药2023年中报披露,截至报告期末,奕凯达®已累计惠及超过500位淋巴瘤患者,被纳入超过90款省市惠民保和超过60项商业保险。2023年6月发布的一项中国多中心真实世界研究数据显示,奕凯达对中国境内复发难治性非霍奇金淋巴瘤患者的真实世界疗效与全球一致,12个月总生存率高达84.3%,最佳总缓解率达83.2%,最佳完全缓解率为58.4%。
而中国第二款CAR-T细胞治疗产品倍诺达®由药明巨诺(2126.HK)推出,药明巨诺成立于2016年4月,由药明康德和美国巨诺公司共同成立,2021年11月3日在港交所主板上市。2021年9月3日,中国国家药监局(NMPA)最新公示,药明巨诺靶向CD19的CAR-T产品瑞基奥仑赛注射液(relma-cel,商品名:倍诺达®)已正式获批,用于治疗经过二线或以上系统性治疗后成人患者的复发或难治性大B细胞淋巴瘤(r/rLBCL)。药明巨诺2023年中报显示,上半年倍诺达®的销售继续强劲增长,上半年共开具了94张倍诺达®处方,完成了85例的回输。倍诺达®已被列入62个商业保险产品及91个地方政府的补充医疗保险计划。85名已回输倍诺达®的患者中有42名患者获得保险补偿,保险赔付比例为38%至100%。
另一家从事相关产品研发的科济药业(2171.HK)2014年成立,2021年在港交所上市,其创始人李宗海是上海市肿瘤研究所癌基因及相关基因国家重点实验室研究组长,从2010年便开始进行CAR-T的研究。公司专注于治疗实体瘤和血液恶性肿瘤的(CAR-T)疗法,主要候选产品泽沃基奥仑赛注射液(研发代号:CT053),此外,CT041是全球首个进入确证性临床试验的实体瘤CAR-T候选产品。12月12日盘后,科济药业发布公告称,公司在美国的子公司收到美国食品药品监督管理局(“FDA”)的通知,要求暂停CT053、CT041和CT071的临床试验,等待对位于北卡罗来纳州达勒姆的生产基地进行检查后得出的结论。
12月26日,全球生物制药巨头阿斯利康(AZN.US)宣布,将以12亿美元的价格收购总部位于中国的亘喜生物(GRCL.US),目前双方已经达成最终协议,交易合计价值约为12亿美元。本次收购将助力阿斯利康加速开发更有效的细胞疗法,尤其是增添GC012FCAR-T细胞疗法,而亘喜生物也将成为国内第一家被收购的Biotech(以研发为主的生物科技企业)。这项交易有望在2024年第一季度完成,交易完成后,亘喜生物将成为一家私有化控股公司,其美国存托凭证将从纳斯达克交易所退市。亘喜生物将成为阿斯利康的子公司,在美国和中国开展业务,但不会影响阿斯利康2023年的财务指引。消息披露后,亘喜生物盘前上涨超过60%,目前市值约为6亿美元。今年以来,亘喜生物股价累计涨幅达170%。
根据公开资料,亘喜生物科技集团是一家处于临床阶段的生物制药企业,致力于开发创新、高效的细胞疗法。公司成立于2017年5月,2021年1月在纳斯达克上市,募集资金总额为2.4亿美元。公司网站显示,其发展目标是:为患者提供供得起,且疗效经济意义较高的免疫细胞疗法,为患者带来福音。
亘喜生物目前有5款在研产品——GC012F、GC509、GC502、GC508、GC506。从路线来说,包括了自体和同种异体,GC012F和GC509基于其FasTCAR平台开发,GC502和GC508基于其TruUCAR平台开发,GC506基于其SmartCAR-T平台开发;从适应症来看,包括了复发/难治性多发性骨髓瘤、新确诊的多发性骨髓瘤、B细胞非霍奇金淋巴瘤、难治性系统性红斑狼疮、急性髓系白血病、急性B淋巴细胞白血病、实体瘤等。

亘喜生物5款在研产品中,最吸引阿斯利康的无疑是GC012F,这款产品在美国的1b/2期临床试验(复发难治性多发性骨髓瘤)正在进行中,初步临床数据展现出了有效性和差异化的安全性;而近一个月,GC012F在美国和中国都拿到了难治性系统性红斑狼疮适应症的临床试验批件,迅速拓展到自身免疫性疾病领域。作为基于亘喜生物FasTCAR技术平台打造的核心产品,GC012F是一款处于临床阶段的创新型BCMA/CD19双靶点自体嵌合抗原受体T(CAR-T)细胞疗法,有望成为针对多发性骨髓瘤、其他各类恶性血液肿瘤以及自身免疫性疾病(包括系统性红斑狼疮)的新一代治疗方案。阿斯利康称,亘喜生物的FasTCAR次日生产技术平台,不但能显著缩短生产时间,还能强化T细胞健康状态,进而有望提高自体CAR-T疗法的有效性。该技术未来也有望应用于治疗罕见病。
数据显示,自2021年下半年起,全球生物医药行业遇冷,产业发展速度和投融资比例增长均持续出现下滑。2021年我国生物医药行业投融资一度达到巅峰,当年发生投融资事件共1009起,投融资金额共2563.8亿元。2022年我国生物医药行业发生融资事件779起,较上年下降22.8%;融资金额为1781.37亿元,较上年下降30.5%。2023年上半年我国生物医药行业的IPO融资是84亿元,较去年上半年缩水了六成以上。在此背景下,不少生物医药企业面临内无粮草外无援军的窘境,而本次国际大厂出手整体溢价收购,一方面亘喜生物确实具有优势,同时也让市场感受到了丝丝暖意。
