亚太地区弥漫性大B细胞淋巴瘤研发见解与经验
转自:IQVIA艾昆纬
弥漫性大B细胞淋巴瘤(DLBCL)在亚太地区的患病率不断增加,提升治疗机会,提高生存质量势在必行。随着生物标志物驱动的研究和精准医药取得新进展,新型治疗的毒性变得更小。因此,医生有机会使用不同的治疗方式更好地治疗DLBCL患者。这对于已用尽所有标准治疗(SOC)方法的患者和对治疗无应答的患者来说尤其如此。在全球试验中,SOC经常改变或增加,因此了解这些变化对亚太地区DLBCL试验的影响很有必要。
与北美和欧洲的情况不同,最新的临床试验并不总是优先考虑在亚太地区开展。因此,新疗法可及性或患者参与临床试验的时间有所延迟。为了解在亚太地区推动临床试验的挑战并促进创新想法的落实,IQVIA成立咨询委员会,并进行了一次问卷调查,参与者涵盖来自8个国家的主要意见领袖,包括澳大利亚、中国、印度、日本、马来西亚、新西兰、新加坡和韩国。本文摘选了报告中DLBCL治疗管理的当前趋势,包括未来临床试验面临的挑战以各个国家地区的潜力等内容。咨询委员会认为,亚太地区在未来的DLBCL临床研究方面具有巨大潜力,亚太地区的临床试验数据可以与世界其他地区同步收集,这将进一步促进APAC地区的疗法获批和可及性。这也有助于了解疗法在安全性和疗效方面的细微差别,特别是在亚洲患者中。
背景
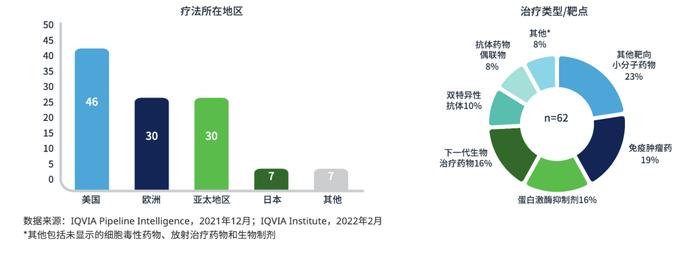
据相关报道,恶性淋巴瘤是最常见的恶性血液肿瘤。淋巴瘤是免疫系统的实体肿瘤,由于流行病学和病因的地理差异,淋巴瘤的恶性程度很高。B细胞非霍奇金淋巴瘤(BNHL)中最常见的类型是DLBCL(图1),占韩国所有BNHL的近46%。
图1:用于淋巴瘤的不同药物类别的支出
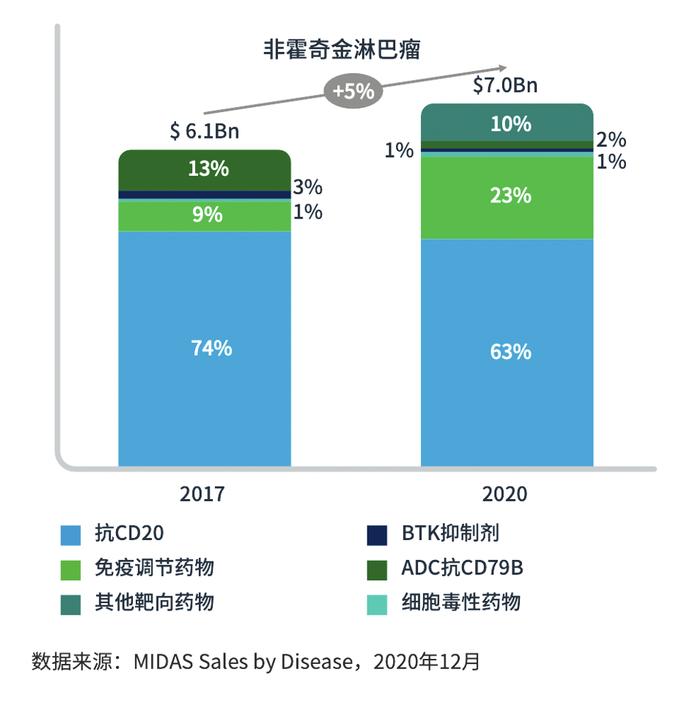
非霍奇金淋巴瘤(NHL)是第七大常见癌症,在全球范围内占癌症确诊和死亡病例的3%。自1975年以来,NHL的发病率增加了168%,在65岁以上的男性群体中很常见。过去几年中,尽管对DLBCL及其病理学的了解有所提高,但仍需要更具靶向性的治疗。约50%-70%的患者可以通过由利妥昔单抗联合环磷酰胺、多柔比星、长春新碱和泼尼松(R-CHOP)组成的标准一线疗法得到有效治疗。然而,使用R-CHOP,约10%的患者耐受,40%的患者出现复发情况。目前已经实施了剂量强化或添加新型药物等几种策略来改善标准方案的疗效,然而,约50%的患者在二线治疗(包括挽救性化疗)后复发。最近,为了克服一线治疗的挑战,嵌合抗原受体(CAR)T细胞、双特异性T细胞衔接子(BiTE)、抗体药物偶联物和新的单克隆抗体等疗法为DLBCL患者提供了新的治疗选择(图2、图3)。
图2:下一代血液肿瘤生物药治疗产品管线
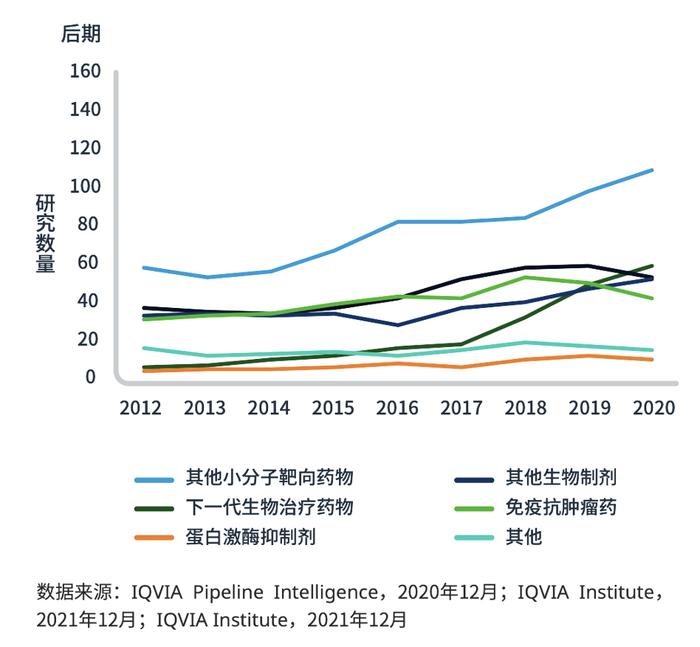
DLBCL新治疗模式的临床试验全球概况
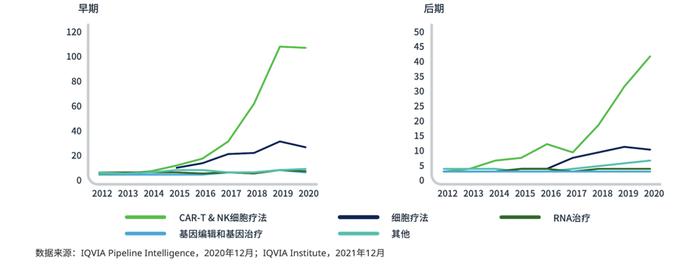
下一代生物治疗药物产品管线的重点是CAR-T和细胞疗法(图4),占DLBCL在研产品的16%(图5)。
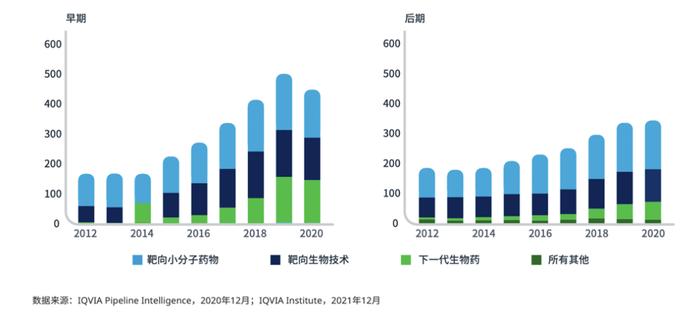
图4:DLBCL的新疗法产品管线(1)
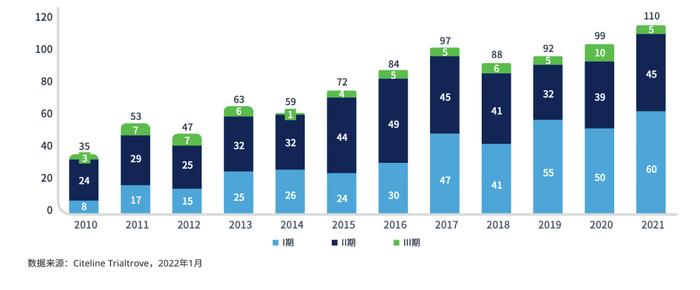
根据最近数据,从2018年到2020年,美国进行了314项NHL试验,而澳大利亚、新西兰、韩国、中国台湾、新加坡、印度、中国香港和泰国共进行了166项试验。此外,DLBCL的临床试验在过去十年中翻了一番。然而,Ⅲ期试验的数量仍然很少(图6)。由于最新的DLBCL临床试验可能并不会优先考虑亚太地区,因此患者缺乏参与此类试验的机会,导致获得此类新疗法的时间较晚。
图6:DLBCL的临床试验进展
随着治疗选择的变化和受更为丰富的生物标志物的驱动,更多临床试验需要在亚太地区进行,而患者的治疗选择也有望增加。
因此,IQVIA成立咨询委员会根据全球临床试验/SOC,确定和缩小在临床试验选项可及性和患者准入方面的差距。本白皮书分享了由专家小组领导的咨询委员会就加强亚太地区DLBCL管理和临床试验开展的现状、挑战和机遇所收集的重要见解。
关于亚太潜力的专家意见
由于亚太地区开放的试验数量很少,患者获得这些创新疗法的机会仍然较少。因此,小组成员一致认为需要在亚太地区进行更多的试验。大多数小组成员指出,挑战之一是能否对不断变化的生物标志物进行相关的实验室评价,以及当前临床试验中实验室评价是否可用。
通过患者准入计划和一些临床试验,可以获得诸如CAR-T细胞疗法和双特异性抗体疗法之类的新疗法。特别是在印度、马来西亚和新西兰等一些国家,人们已注意到缺乏CAR-T细胞疗法的问题。在日本、澳大利亚和韩国等国家,商业CAR-T疗法已经可用,并开展了一些临床试验。然而,未满足需求仍然很明显。
在亚太地区开展更多试验将增加DLBCL患者的治疗选择,特别是对那些已经用尽所有可用SOC药物的患者和标准治疗无效的患者。在新加坡,目前正在进行双特异性抗体试验;这些试验为难治或易复发疾病患者带来了希望。
亚太地区DLBCL试验的未来
咨询委员会重点了解了亚太地区在开展DLBCL临床试验所具备的专业知识和患者获得最新治疗方面是否与全球其他国家不相上下。了解亚太地区在开展临床试验方面相对落后的方面和原因是非常重要的。咨询委员会还指出亚太地区拥有充足的专业知识,可以参与全球不断发展的肿瘤试验、区域试验和更多的本地临床试验。
由于在亚太地区开展的试验是在美国或欧洲试验的末期或中期开始的,因此有必要了解哪些因素将使亚太地区与其他地区联合考虑进行DLBCL临床试验。评估亚太地区的能力增加了我们参与全球临床试验的机会,并将使我们能够及时为患者提供更多的治疗选择。考虑到未来的治疗可能更多地受生物标志物驱动,咨询委员会建议亚太地区对此拥有一定的兴趣、患者库和能力,必要时可以进一步增强(图7)。
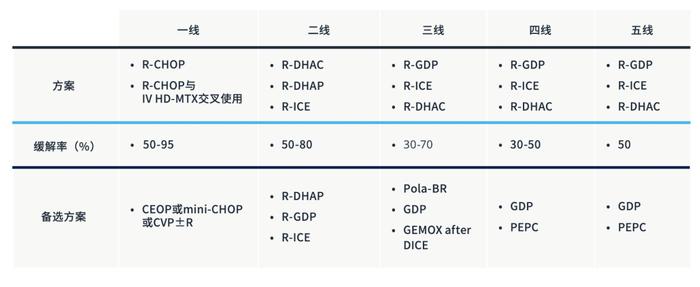
表1:各线治疗的首选方案

中国DLBCL治疗的现况与挑战
近年来,随着老龄化趋势凸显,中国淋巴瘤发病率不断上升,每年新发病例约有10万,90%为NHL,其中DLBCL约占40%。淋巴瘤因其治疗靶点多、机制相对明确,新药研发成功率高而备受青睐。在中国,2018-2020年,ClinicalTrials.gov登记的NHL临床试验共679项,其中针对DLBCL的临床研究123项,涉及小分子靶向药物,ADC类药物,单克隆抗体,双特异性抗体,CAR-T细胞治疗等。
考虑到淋巴瘤的异质性,联合治疗是一个重要的策略。例如,如何通过“R-CHOP+X”策略进一步提高DLBCL的疗效是临床研究的焦点之一。中国自主研发的BTK抑制剂泽布替尼和奥布替尼近期分别开展了联合标准化疗方案R-CHOP一线治疗DLBCL的有效性和安全性的II期临床试验。此外,2022年,全球首个靶向CD19的ADC药物Loncastuximabtesirine与利妥昔单抗联合疗法的III期有效性和安全性全球临床试验在中国启动,主要针对二线及以后且不符合移植条件的DLBCL患者。
双特异性抗体是淋巴瘤治疗领域的研发热点。相比较单抗,双抗在疗效、安全性方面更具优势。中国庞大的淋巴瘤患者基数为双抗在中国商业化提供了可能。根据相关报道,预计2024年中国市场双抗的规模将达到50亿元。双抗的研发仍处于早期快速发展阶段,III期临床试验数量仍然很少。CD20xCD3为目前DLBCL最主要的双抗研发的靶点。作为新兴的生物类药物,双抗在临床疗效、安全性、免疫原性、药代药效学、临床及商业化可行性等方面仍存在多种挑战。这些要点与双抗平台的设计息息相关。中国国家药监局药审中心(CDE)于2022年11月发布了《双特异性抗体抗肿瘤药物临床研发技术指导原则》,进一步明确了双抗的定义、特点,并对双抗研发的立项和临床研究做出了细致明确的要求和引导。
CAR-T疗法是治疗复发或难治性DLBCL的另一个研发热点。除来自生物制药领域的专业研发团队外,由研究者自主开发CAR-T产品并发起临床试验在中国也非常常见,CAR-T治疗桥接造血干细胞移植的联合治疗方案取得了良好的效果。但到目前为止,CAR-T疗法的商业化应用仍受到诸多因素的限制,如潜在的毒性作用,操作的可行性,疗效的持久性以及经济因素等都需要进一步优化。此外,是否可取代自体造血干细胞移植目前也还存在诸多争议,需要更多的临床试验数据进行验证。
更多详情,敬请垂询:
JunHou
IQVIA艾昆纬医学总监
jun.hou@iqvia.com
