异种器官移植如何技术破局
张田勘
5月17日,安徽医科大学第一附属医院孙倍成教授团队和云南农业大学魏红江教授团队合作,成功将10基因编辑供体猪的肝脏移植给一位71岁的肝癌患者,术后第7天患者能下地自由活动,没有出现超急性和急性排斥反应,肝功能恢复正常。这次手术,开创了基因编辑猪异种肝移植的先河。
此前,同样曾引起医学界瞩目的人类首例基因编辑猪心脏移植、首例基因编辑猪肾移植手术,因受者大卫·贝内特、理查德·斯莱曼先后于2022年、2024年去世,似乎又为异种器官移植笼罩上了“失败”的阴云。那么,人类为何执着于研究异种器官移植?假以时日,异种器官移植会像同种器官移植般突破技术瓶颈,成为未来拯救人类生命的主流医疗技术吗?
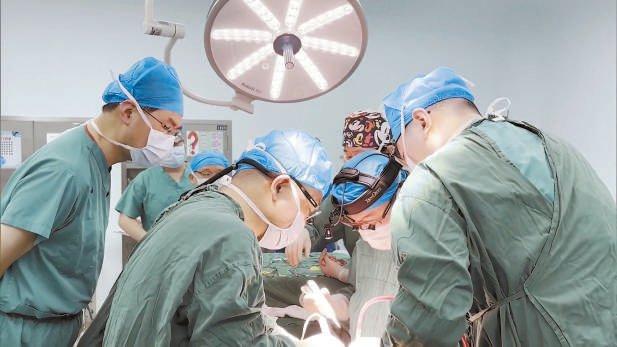
2024年5月17日,安徽医科大学第一附属医院孙倍成教授团队和云南农业大学魏红江教授团队合作完成世界首例猪肝脏移植人体手术。
克服免疫排异是重中之重
异种器官移植是把不同物种的动物或细胞来源的活细胞、组织和器官移植给人或其他动物,如把猪的器官移植给人或黑猩猩。
人类历史上最早的异种器官移植是把动物血液输给人。1667年6月15日,一位15岁的男孩因水蛭叮咬而流血过多,法国路易十四的御医让-巴蒂斯特·德尼从一只绵羊身上抽取了12盎司(约340克)血液输给男孩,后者因而得救。后来的科学家分析认为,这次输血成功很可能是因为仅有少量绵羊血真正输入受者体内,所以没有引发严重排异反应。
到了20世纪初,临床医生多次尝试将羊、黑猩猩、猴子、兔子的肾、心、肝等器官移植给人,但无一例外,受者很快出现排异反应及移植物衰竭,最终死亡。最成功的异种器官移植采用的是美国eGenesis公司研究团队培养的尤卡坦迷你猪器官,2023年发表的一篇论文称,把经过基因编辑的尤卡坦迷你猪的肾移植到食蟹猴体内,其中有一只食蟹猴已经存活了两年多。这是目前接受异种器官移植存活时间最长的受者,但遗憾的是,受者并非人类。
人类如何能在异种器官移植领域取得突破,终有一天安全用于医疗,是科学家孜孜不倦探索的目标。
当前异种器官移植面临技术、伦理等问题。其中,导致异种器官移植屡屡失败的主要原因是技术问题。
在技术方面,有很多难题需要解决,包括克服免疫排异反应、控制炎症反应、调节凝血紊乱、提高移植物生理相容性、优化免疫抑制剂使用方案、筛选供体基因编辑类型、选择适宜受者人群、完善异种移植指南等。仅仅是克服免疫排异反应这一点就困难重重。
免疫排异反应体现在两方面,一是宿主抗移植物反应,即受者对供者组织器官产生排异反应;二是移植物抗宿主反应,即移植物(移植的组织、器官)中的免疫细胞对宿主的组织抗原产生免疫应答并引起组织损伤。其实,无论是同种器官移植还是异种器官移植,免疫排异反应都可能发生,多见于宿主抗移植物反应。以同种器官移植为例,免疫排异反应发生的主要原因是受者和移植物的人类白细胞抗原(HLA)不同。供者与受者HLA的差异程度决定了排异反应的轻或重。除了同卵双胞胎,两个个体并不具有完全相同的HLA系统组织配型,因此即便是同种器官移植,也要为受者选择HLA配型尽可能接近的供者,这是减少器官移植后发生排异反应的关键。由此可知,异种器官移植面临的困难有多大。
免疫排异反应是由细胞免疫和体液免疫引发的,可细分为超急性排异反应、急性排异反应和慢性排异反应。其中,超急性排异反应和慢性排异反应主要由体液免疫介导,急性排异反应主要由细胞免疫介导。
超急性排异反应一般发生在器官移植后24小时内,出现坏死性血管炎表现,移植物功能丧失,受者常伴有全身症状,其主要原因是受者体内存在针对供者器官的HLA抗体。这种排异反应常在异种器官移植中出现。
急性排斥反应是最常见的移植排异反应,通常出现于器官移植后一周到几个月内。典型的急性排异反应表现为发热、移植部位胀痛和移植器官功能减退等。病理特点是移植物实质和小血管壁上有以单个核细胞为主的细胞浸润、间质水肿与血管损害,后期在大动脉壁上有急性纤维素样炎症。
慢性排异反应可在器官移植后数月至数年发生,表现为移植器官的功能进行性减退直至丧失,主要病理特征是移植器官的毛细血管内皮细胞增生,使动脉狭窄并逐渐纤维化。
基因修饰不能取代免疫抑制治疗
近年来,多基因编辑猪的异种器官移植技术在美国取得重大进展。人类首例基因编辑猪心脏移植者大卫·贝内特、首例基因编辑猪肾移植者理查德·斯莱曼虽然于2022年、2024年去世,但移植时均克服了异种器官移植特有的超急性排异反应,这也是他们术后能存活近2个月的重要原因。
为了避免免疫排异反应,科学家需要对猪器官进行基因编辑,包括敲除会引起人类排异反应的基因,以及添加一些人类基因以改善动物器官与人体的兼容性。此外,在基因编辑中还会让猪体内的内源性逆转录病毒、猪巨细胞病毒等失活,以防相关病毒影响受者。
以猪内源性逆转录病毒为例,这是一类RNA病毒,对人体具有较高风险,无法通过无菌培养和筛选等传统措施排除。而且,猪身上有3种类型的内源性逆转录病毒,其感染能力不同,PERV-A和PERV-B可以克服物种障碍,传播后可能感染人类,虽然PERV-C主要感染猪细胞,但它可与PERV-A重组产生PERV-A/C,进而感染人体细胞。因此,通过基因编辑去除猪逆转录病毒和其他能引起人免疫排异反应的基因是可行的,由此能提高猪器官供人移植的成功率。
另外,猪器官的细胞表面有一种叫作“α-1,3-半乳糖”的糖分子,它能在几分钟内引发器官排异反应,即超急性排异反应。而“α-1,3-半乳糖”依赖于“α-1,3-半乳糖基转移酶”,如果将产生这种酶的基因敲除,就能去除超急性免疫排异反应。目前,科学家利用基因剪刀CRISPR/Cas9已经实现同时敲除3个关键猪糖分子基因,以排除超急性排异反应。
前面提到的贝内特和斯莱曼接受异种器官移植手术后仍然去世,有多方面的原因。
贝内特去世的初步原因被认为是心力衰竭。导致其心力衰竭的原因包括在移植前身体健康状况不佳、免疫功能严重受损等。这限制了移植前后有效抗排异药物和技术的使用,使患者自身免疫系统更容易产生对器官的排斥。研究人员在贝内特身上还发现了抗体介导排异反应的间接证据,表明猪心上的抗原和病毒等都可能导致免疫排异反应而致异种器官移植失败。
对贝内特死因的研究引起了如何使用免疫抑制剂的讨论,因为基因修饰不能完全代替免疫抑制治疗,无论是同种还是异种器官移植,在移植后都需要使用免疫抑制剂,以减缓受者机体对植入器官的排斥。但由于机体对异种器官的排异更为强烈,术后使用免疫抑制剂的效果有限,这也是贝内特的一个重要死因。
不同于贝内特移植手术后死于医院,斯莱曼是活着出院的,不久后才去世,这意味着可能还有其他死亡原因,目前研究结果尚未公布。斯莱曼患有2型糖尿病、高血压和肾病,早在2018年他就做过人体来源的肾脏移植手术,但5年后该器官出现衰竭。他于2023年5月开始接受肾透析并出现并发症,需要每两周去一次医院,生活质量受到严重影响。后来,美国食品和药物管理局(FDA)基于“同情使用”原则,批准对斯莱曼进行试验性异种器官移植手术。因此,他的死亡或许与自己的基础疾病恶化有关。
受者存活时间是移植成功金标准
在贝内特死亡后,纽约大学朗格尼医学中心又先后将转基因猪心脏移植到了一男一女两名脑死亡患者身上。针对男性受者移植结果较差的原因,研究人员认为是移植的猪心过小,而女性受者体重较轻、体格较小,移植的猪心相对适合。这表明,异种器官移植的生理相容性也是判定成功与否的重要因素。
生理相容性表现为供体器官与受体器官大小及功能匹配。尽管猪的器官大小与人相似,但其生长速度与人并不同步,如猪的心脏会过度生长,因此采用猪心需敲除猪的生长激素受体基因。此外,还有许多生理相容性亟待解决。人和猪的促红细胞生成素受体差异明显;人肾和猪肾功能大致相同,但在调控肾脏渗透压、钙磷代谢和肾素-血管紧张素-醛固酮系统的作用方面仍有不同;人和猪的肝脏在凝血和功能调节上存在物种差异;猪心和猪肾所产生的100多种蛋白质对于人体几乎没有作用……这些都有可能阻碍异种器官移植的成功。
科学界对于器官移植的成功有多种衡量标准,但最具有说服力的是移植后受者的存活时间。如果器官移植能使受者存活一年以上,便算得上是初步成功,目前最被认可的衡量标准是,5年生存率(指移植后受者生存5年的比率)、10年存活率和生存时间。
现在,同种器官移植心、肝、肺的5年生存率在50%以上,肾移植的10年生存率已经超过60%。相比而言,肾移植者最长存活年限达30年;其次是骨髓移植,受者最长存活年限为25年;肝脏移植者位居第三,最长存活年限达23年;第四位是心脏移植,受者存活最长的为22年。
以此衡量,对人的异种器官移植无论是猪心还是猪肾,受者存活时间都没能超过2个月似乎是一种失败。前文中提到的中国首例猪肝脏异种器官移植患者目前存活时间还未到1个月,需观察下一步进展。但是,从宏观和长远的历史层面来看,无论是美国还是中国的猪心、猪肾和猪肝异种移植都是现代医学划时代的成功。1967年12月2日,南非开普敦赫鲁特斯库尔医院的心脏外科医生克里斯蒂安·巴纳德为一位53岁的患者进行了全球首例人心脏移植手术,受者术后仅存活了18天。与之相比,现在全球第一例异种心脏、肾脏受者都存活了近2个月,应算是一种巨大的成功。
异种器官移植或成未来主流技术
基于经济、可持续性、伦理、社会等种种原因,异种器官移植将是未来器官移植的必由之路。因为从现状来看,同种器官移植由于供体器官短缺,每年只有不到10%的人可以进行手术。仅中国每年就有约30万人等待器官移植,实际完成移植的仅占很少一部分。
在所有动物器官中,猪的器官大小、重量、解剖和生理学结构与人类器官最为吻合,而且,猪生长快、饲养成本低、易于繁育,是异种器官来源的首选。一旦突破了技术难题,并能商业化繁殖和饲养,猪器官的移植费用显然要比同种器官低得多。
异种器官移植将成为未来主流医疗技术的另一个重要原因是,可以实现社会公平的最大化。比如,可以打击黑市人体器官市场。当异种器官能满足大量移植需求时,自然就会杜绝器官私下买卖和遥遥无期的等候。
当然,异种器官移植本身也存在伦理问题。例如,有人会忌讳动物器官,认为可能产生“非人”现象。但如果有一天异种器官移植能更好、更快、更廉价地治愈患者的病痛、挽救生命,相信一切难题都能找到新的解决办法。
显然,今后相当长一段时间内,异种器官移植的重中之重都是解决技术问题。当技术问题得到充分解决时,就是这种移植方式普遍为人类社会所接受并走向主流医疗技术之列、拯救人类生命之时。
