CDE:2个药学变更和临床研究技术指导原则再征意见!
转自:蒲公英Ouryao
转自:CDE编辑:水晶
8月28日,CDE公开征求《临床试验期间生物制品药学变更和研究技术指导原则》和《已上市疫苗药学变更研究技术指导原则》。这是第2次公开征求意见(2020年9月10日和2019年9月2日首次公开征求意见)。

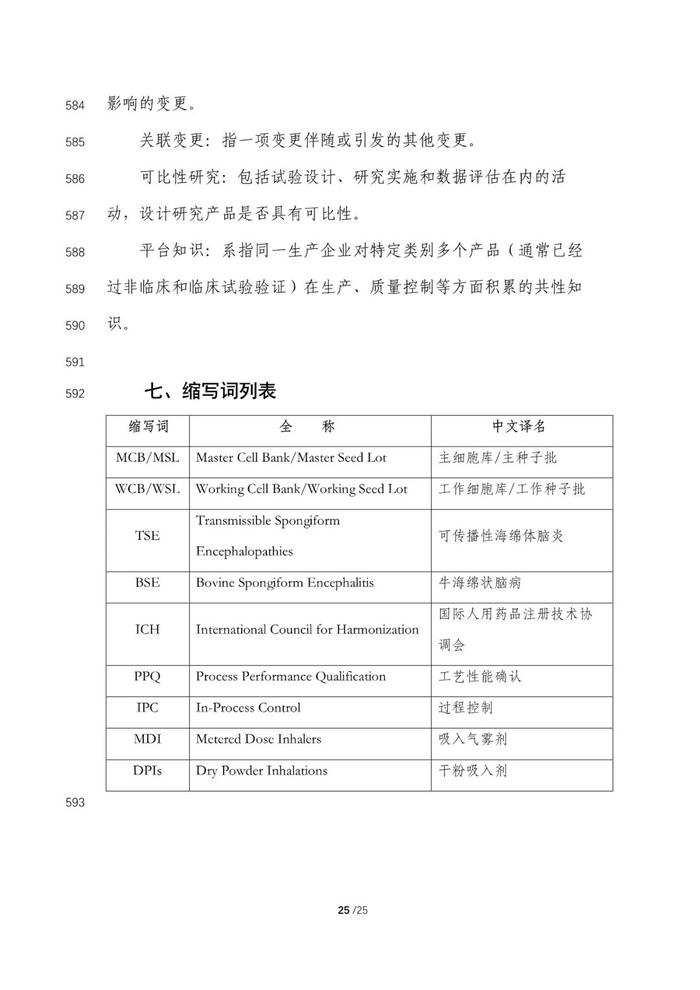
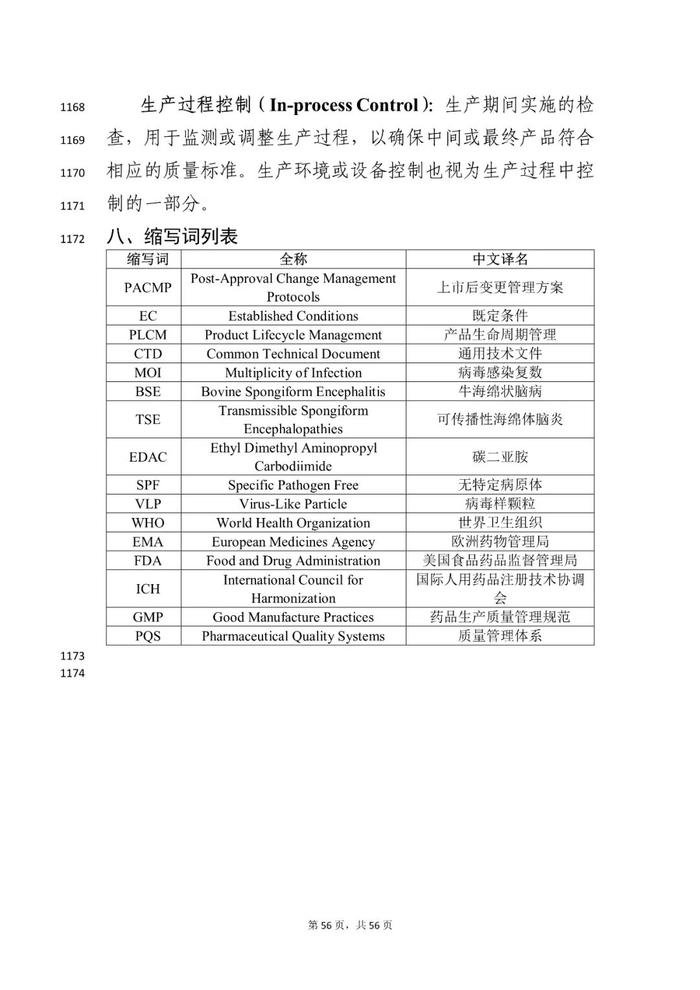
《临床试验期间生物制品药学变更和研究技术指导原则》分为七部分,包括前言、一般原则、药学研究阶段性要求、药学变更管理和影响安全性的重大变更示例、参考文献、名词解释、缩写词列表。
《已上市疫苗药学变更研究技术指导原则》的基本内容分为:前言、基本考量、变更分类、沟通交流、疫苗药学变更分类和技术要求、参考文献、名词解释、缩写词列表共八个部分。
《已上市疫苗药学变更研究技术指导原则》二次征求意见的内容变化:
为更好体现疫苗原液和制剂的关联性,CDE将2019年9月征求意见稿中“原液(抗原)阶段”和“制剂(疫苗)阶段”统一列入“疫苗药学变更的分类和技术要求”中。
基本考量部分:根据疫苗的特点在关联变更、佐剂、质量特性研究、桥接临床等方面进行了针对性的具体论述及修订,但仍然强调基本考量在疫苗药学变更中的重要性,在疫苗药学变更中需结合《已上市生物制品药学变更研究技术指导原则(试行)》相关要求充分落实。
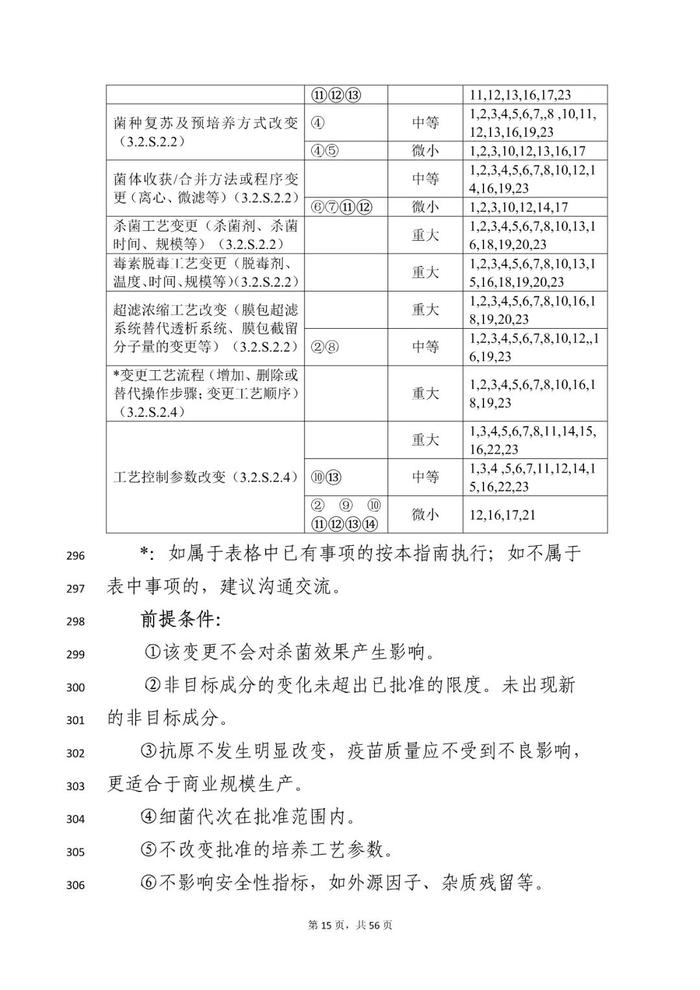
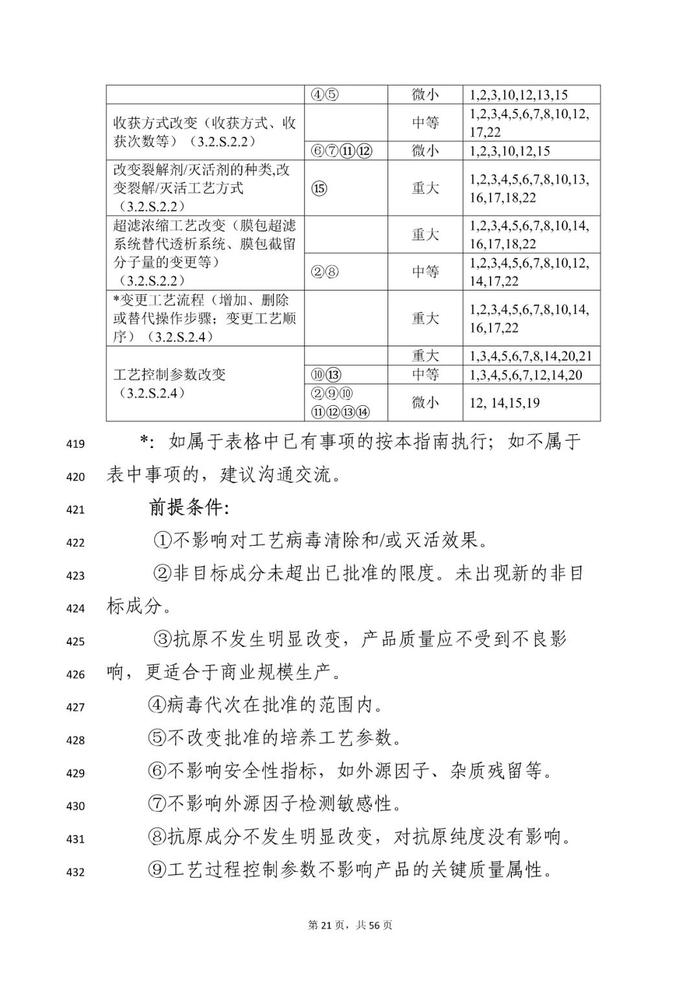
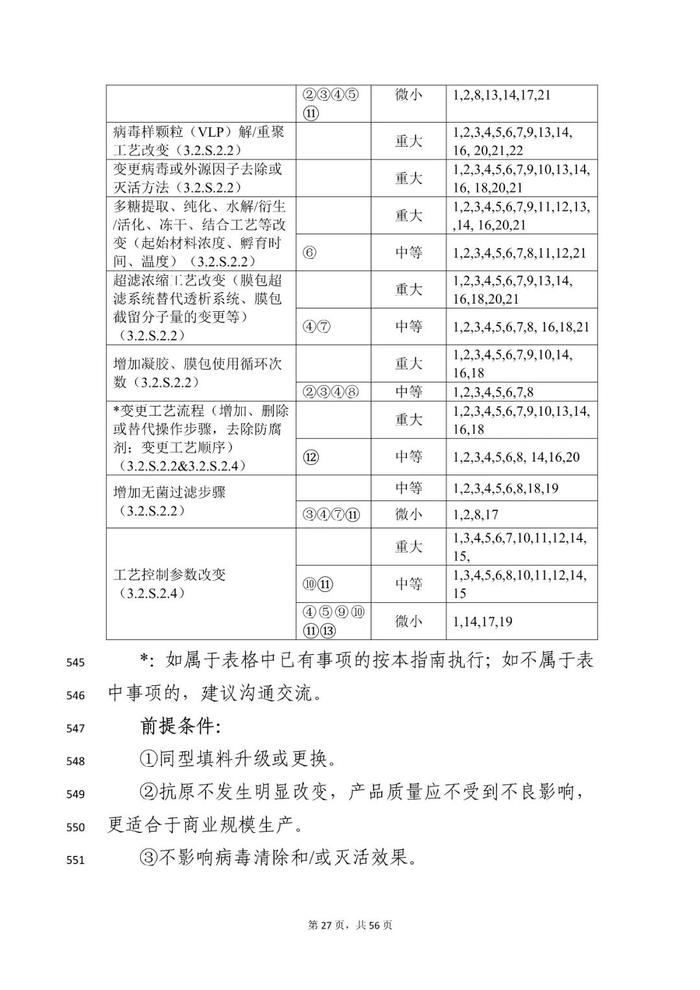
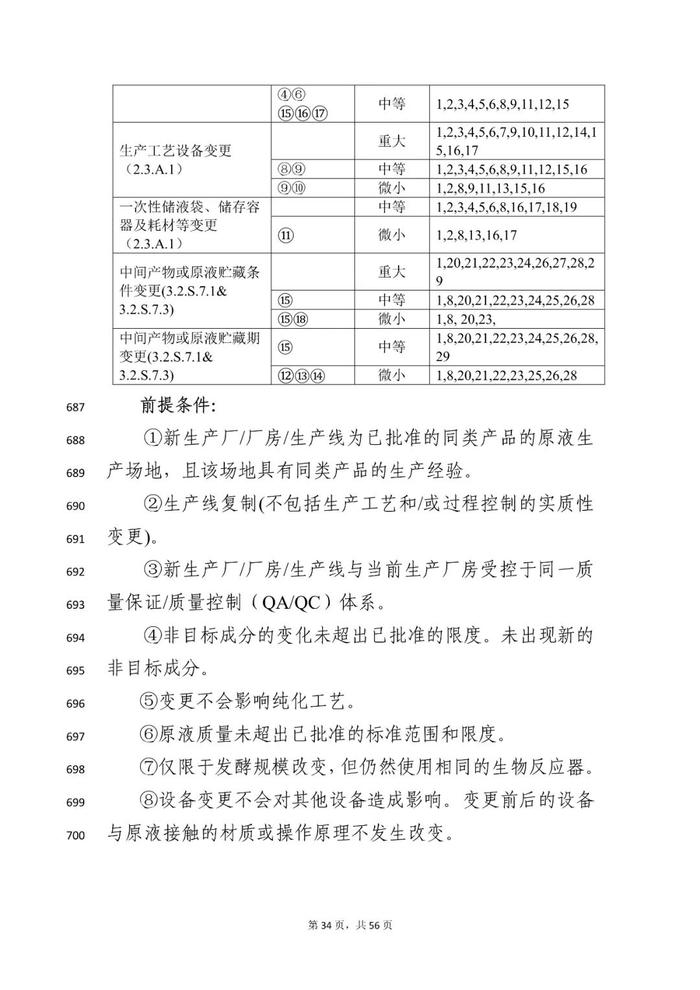
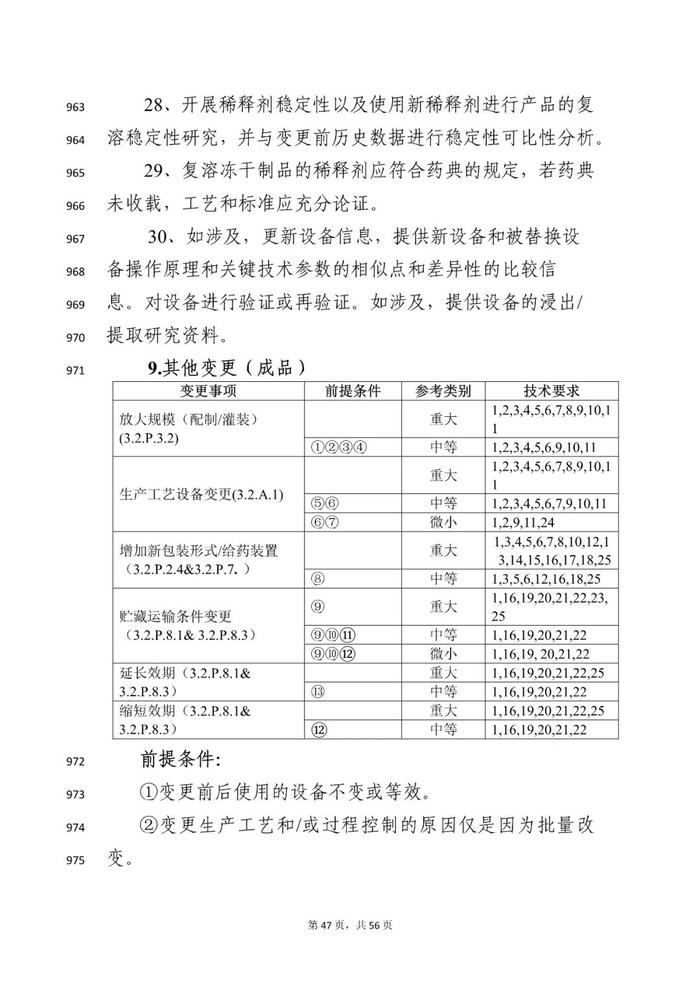
变更事项部分:本指导原则对疫苗生产工艺变更进行了重点阐述。疫苗生产工艺变更是指对已获得上市许可疫苗的生产全过程所进行的各项变动,涉及生产工艺、过程控制等各个方面。
本指导原则从技术角度阐述疫苗上市后生产工艺变更研究的基本思路和关注重点,明晰目前疫苗生产工艺常见变更事项的分类以及需要开展的支持性技术要求,对疫苗生产工艺变更事项进行细化,如,将上游发酵工艺按照培养物特性分类分为细菌培养物制备、病毒培养物制备、基因工程细胞培养物制备等部分;将下游工艺按照不同技术路线分类,分为传统疫苗、基因工程疫苗、多糖-蛋白结合疫苗等不同工艺路线。
对于工艺变更尽可能涵盖常见的变更事项及共识的共建工艺步骤和/或工艺参数变更。由于部分疫苗在上游培养体系可能存在适用情形的交叉,建议申请人根据具体产品特点,综合不同部分要求开展相关疫苗的生产工艺变更研究,如,采用基因工程菌(如,酵母、大肠杆菌、白喉杆菌等工程菌表达的重组蛋白疫苗或蛋白载体等)表达的重组蛋白疫苗,工艺变更可能需要同时考虑细菌培养物、基因工程细胞培养物及重组蛋白疫苗的技术要求;采用病毒表达载体系统生产的基因工程疫苗(如,杆状病毒系统制备的重组蛋白疫苗)工艺变更可能需要同时考虑细菌培养物、细胞培养物及重组蛋白疫苗的技术要求。
沟通交流部分:由于疫苗药学变更复杂,一个变更事项可能涉及多个变更内容,不同企业在早期研发及上市后持续工艺验证中对产品知识、工艺知识及平台知识积累有所不同,变更分类的前提涉及关键工艺/非关键工艺等判定,且涉及对研究结果的综合判定。
此外,由于本指导原则无法涵盖所有变更事项,且科技创新速度不断加快,为了便于持有人实施变更,本指导原则强调沟通的重要性。
根据国家药监局的有关要求,我中心组织起草了《临床试验期间生物制品药学变更和研究技术指导原则》和《已上市疫苗药学变更研究技术指导原则》(原公开征求意见时名称为《疫苗上市后生产工艺变更研究技术指导原则》),并分别于2020年9月10日和2019年9月2日首次公开征求意见。
为进一步保障公众用药安全、有效,完善和规范生物制品临床试验期间变更和疫苗上市后药学变更的研究,我中心对两个指导原则进行第二次上网公开征求意见,欢迎各界提出宝贵意见和建议。
您可将意见发到中心联系人的邮箱。
1.《临床试验期间生物制品药学变更和研究技术指导原则》
联系人:邱晓、阚红金,E-mail:qiux@cde.org.cn、kanhj@cde.org.cn
2.《已上市疫苗药学变更研究技术指导原则》
联系人:郭舒杨、金苏,E-mail:guoshy@cde.org.cn、jins@cde.org.cn
征求意见截止时间:自公布之日起1个月。
感谢您的参与和大力支持!
国家药品监督管理局药品审评中心
2023年8月28日